RNA修飾代謝による生体防御機構を解明 -有害な修飾ヌクレオシドから体を守る仕組み-
2025.8.21 Thu
研究発表のポイント
- 化学修飾されたRNAが代謝されると修飾ヌクレオシド1が生じますが、その機能や意義については十分に解明されていませんでした。
- 本研究により、修飾ヌクレオシドのうち、毒性をもっているm6A, m6,6A, i6A2の3種が2種類の共通の酵素によってIMP3へ代謝され、無毒化する代謝経路が存在することがわかりました。
- この代謝経路は進化的に保存されており、とくに哺乳動物では糖代謝や脂質代謝と関連する可能性が示されたことで、今後、修飾ヌクレオシドと疾患発症の関連性について、より深い理解が進むことが期待されます。
概要
RNAはさまざまな化学修飾を受け、現在までに約150種類以上が同定されています。これまで、細胞内におけるRNA修飾の役割については研究が進んでいましたが、RNA修飾が代謝された後に生じる修飾ヌクレオシドの機能や意義については十分に解明されていませんでした。
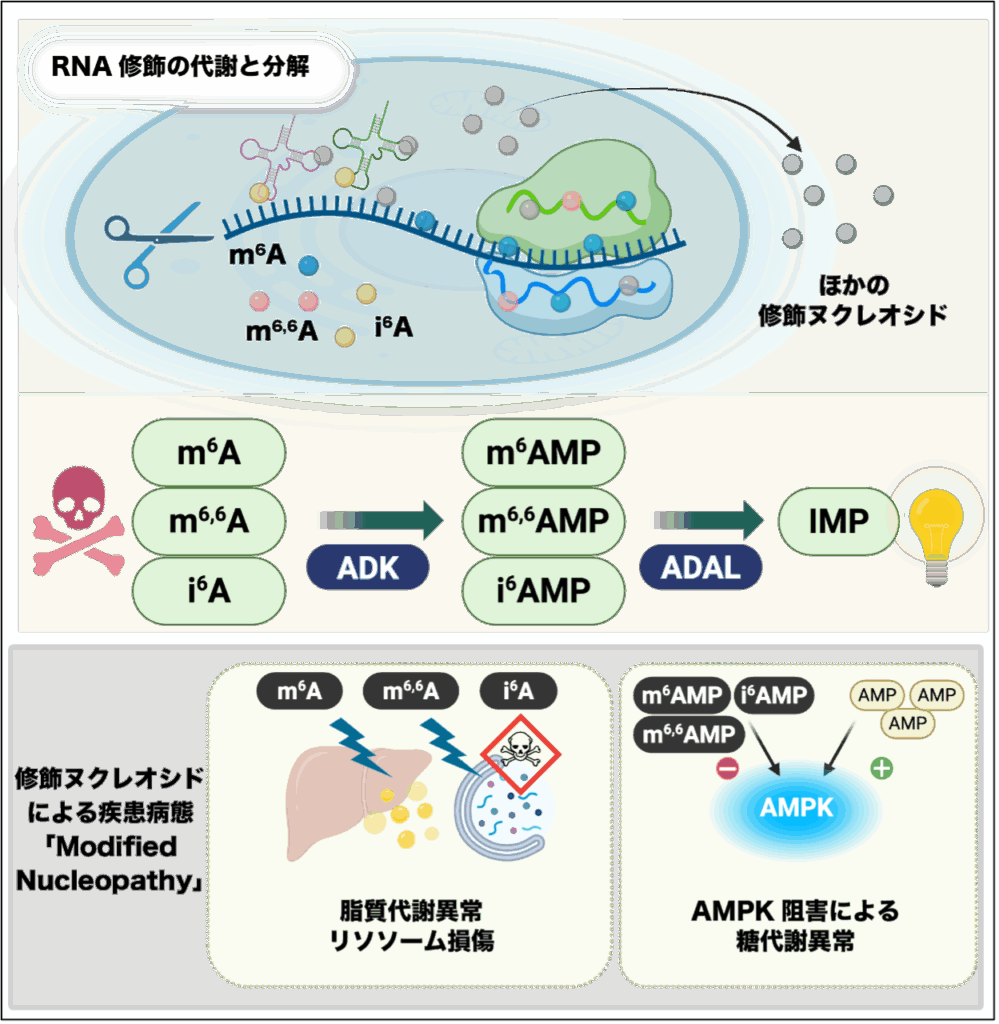
東北大学 加齢医学研究所の小川 亜希子助教(当時、現所属は薬学研究科准教授)、魏 范研教授、生命科学研究科の田口 友彦教授、医学系研究科の中澤 徹教授らは、九州大学 生体防御医学研究所の渡部 聡准教授、稲葉 謙次教授、農学研究院の有澤 美枝子教授、熊本大学 生命資源研究・支援センターの荒木 喜美教授、生物環境農学国際研究センターのアレン イールン ツァイ助教、澤 進一郎教授らとの共同研究、およびライプツィヒ大学やハーバード大学などとの国際共同研究により、修飾ヌクレオシドのうち、m6A、m6,6A、i6Aが毒性を持ち、酵素ADKとADALによって無毒なIMPへ代謝されるという経路を発見しました。この経路が破綻すると修飾ヌクレオシドやその中間代謝物が蓄積して糖代謝や脂質代謝の異常が生じ、さらにはリソソームなどの細胞小器官4の機能不全が起こることが毒性の原因であることを同定しました。
本研究によって同定された酵素の一部はすでにヒト疾患が報告されており、今後、修飾ヌクレオシドが病態解明や治療開発に繋がる可能性があります。
本研究結果は2025年8月20日付で科学誌Cellに掲載されました。
詳細な説明
研究の背景
ヌクレオシドはRNAの構成成分であると同時に生理活性因子5として機能し、生体中でシグナル伝達などを行います。従来、アデノシンやATP6といった未修飾の核酸によるシグナル伝達経路が主に研究されてきましたが、近年、RNAに多様な化学修飾が存在することが明らかとなり、概念の再構築が求められています。とりわけ、アデノシン以外の核酸型因子の多様性や機能についてはほとんど未解明でした。
本研究グループはこれまで、RNA修飾に関わる酵素が数多く存在する一方で、脱修飾機構が極めて限られる点に着目し、RNA修飾の代謝・分解後に生じる「修飾ヌクレオシド」に着目した研究を行ってきました。
まず、修飾ヌクレオシドの網羅的測定法がこれまで確立されていなかったことから、低分子抽出法を改良し、代謝系に最適化することで、生体中に存在する修飾ヌクレオシドを複雑なマトリックスに埋もれることなく高感度に質量分析で解析する手法を確立しました(STAR Protocols, 2021)。この手法により、わずか数マイクロリットルの血清や尿といった生体サンプルから網羅的な修飾ヌクレオシド解析が可能となり、予想を大きく上回る量や種類の修飾ヌクレオシドが生体中に豊富に分泌されていることがわかりました。
さらに、修飾ヌクレオシドの一つであるm6A(N6-methyladenosine)が未修飾のアデノシンの10倍以上の活性でアデノシンA3受容体7を活性化し、アレルギーや炎症といった免疫応答を惹起することを報告しました(Molecular Cell, 2021; Nature Communications, 2024(東京大学との共同研究))。これらの一連の結果は、修飾ヌクレオシドが単なる終点産物ではなく、新たな生理活性因子として機能しうることを示しています。しかし、ほとんどの修飾ヌクレオシドの機能は知られていませんでした。
今回の取り組み
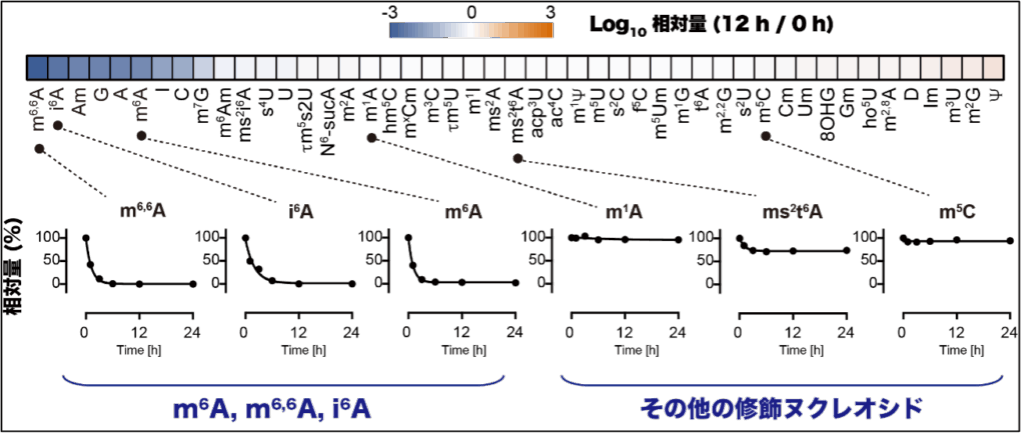
本研究グループはまず、様々な修飾ヌクレオシドをヒト培養細胞に投与したところ、細胞培養条件や細胞種にかかわらず、m6A, m6,6A(N6, N6-dimethyladenosine), i6A(N6-isopentenyladenosine)が毒性を持つことを明らかにしました(図2)。次に修飾ヌクレオシドを細胞培養上清液に投与すると、大部分の修飾ヌクレオシドは安定して存在する一方で、m6A, m6,6A, i6Aは短期間で消失することからm6A, m6,6A, i6Aは他の修飾ヌクレオシドと異なる代謝・分解機構が存在することが示唆されました(図3)。
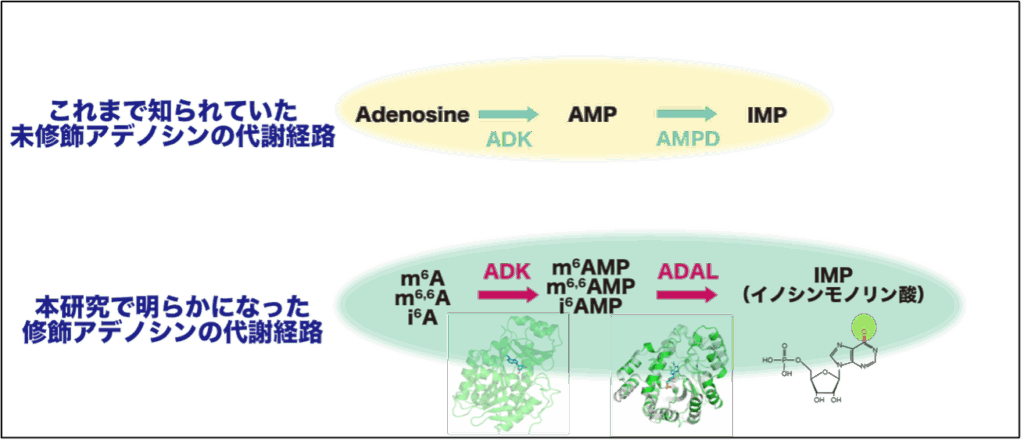
そこで化合物のスクリーニングを行うことで、m6A, m6,6A, i6Aに共通する代謝機構としてアデノシンキナーゼ(adenosine kinase:ADK)によるリン酸化8を受け、それぞれm6AMP, m6,6AMP, i6AMPになることがわかりました。一方で、m6AMP, m6,6AMP, i6AMPは通常生体中ではほぼ存在しないことから更なる代謝機構の存在が示唆され、系統樹解析などの結果によりこの反応で中心的な役割を担う酵素としてADAL(adenosine deaminase-like)を同定しました。すなわちm6AMP, m6,6AMP, i6AMPはADALによってIMP(inosine monophosphate)へと脱アミノ化9されて通常の核酸代謝経路へ合流するという修飾ヌクレオシドの新たな二段階の代謝経路を同定しました(図4)。この代謝経路は、生化学実験およびホモロジーモデル10による構造の視点からも親和性を裏付けることができました。
ADKは元来、未修飾のアデノシンをAMPへとリン酸化する酵素として知られていましたが、修飾アデノシンへの触媒効率はアデノシンと同等もしくはそれ以上であり、新たな内在性のリガンド11が明らかになりました。一方でADALは主に真核生物12のみに存在しており、分類上はADA(adenosine deaminase)ファミリーの1種ですが、特に哺乳動物ではその機能について明らかになっていませんでした。
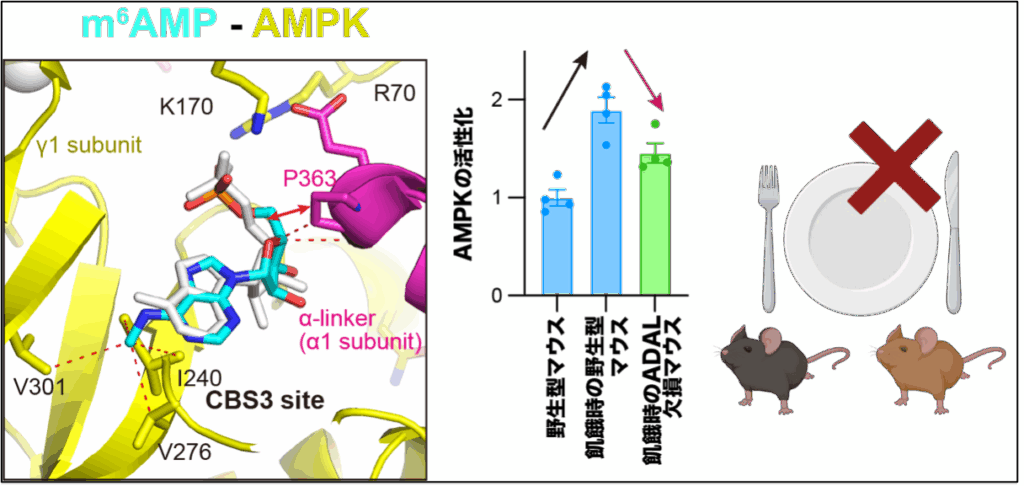
そこでADAL欠損マウスを作成して表現型解析を行ったところ、耐糖能異常13が認められました。ADAL欠損マウスではADAL以下の経路が機能しないためその中間代謝体であるm6AMP, m6,6AMP, i6AMP(以下、修飾AMP)が蓄積しています。そこで耐糖能異常を示すメカニズムとして本研究グループはAMPK(AMPキナーゼ)に着目しました。一般的に、AMPKは細胞内のエネルギーセンサーとして機能し、飢餓などでエネルギーが枯渇した場合にAMP/ATP比が大きくなると活性化されます。本研究グループがAMPKに対する修飾AMPのホモロジーモデリングを施行した結果、修飾AMPはAMPに対するアロステリック14な阻害効果を示すことがわかりました(図5左)。更に、マウスの絶食時などにおいてはAMPKが活性化することが知られていますが、修飾AMPが蓄積しているADAL欠損マウスにおいてはAMPKの活性化が減弱しており、これが耐糖能異常を示すメカニズムの一つであると考えられました(図5右)。
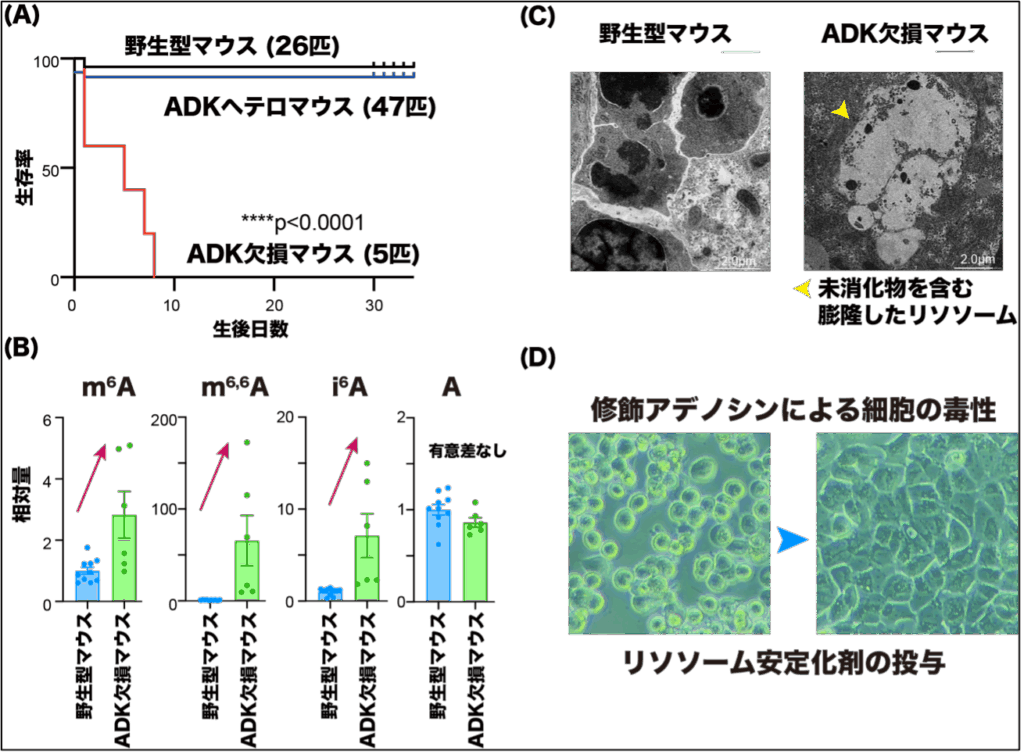
一方で、ADKはヒトでミスセンス変異15に伴う欠損症が報告されており肝障害、てんかんや発達異常といった重篤な症状を呈しますが、その詳細なメカニズムはわかっておらず有効な治療法も存在しません。ADK欠損マウスは生まれる数も少なく、生まれたとしても全個体が生後まもなく死亡する重篤な表現型を示し(図6A)、有意なm6A, m6,6A, i6A(以下、修飾アデノシン)の上昇が見られました(図6B)。ADKノックアウトマウスの肝臓を採取してメタボローム解析およびRNAseq、イメージング解析などを施行したところ、脂質代謝関連遺伝子の大幅な低下が認められました。なぜ修飾アデノシンの蓄積が脂質代謝阻害や毒性を引き起こすのかを調べるために、ケミカルプロテオミクス16を行い、相互作用しているタンパク質を解析したところ、リソソームに代表される細胞小器官に集中していることがわかりました。
透過型電子顕微鏡により細胞内構造を詳細に調べると、ADKノックアウトマウスの臓器で顕著なリソソームの膨化と消化不全が認められ、修飾アデノシンがリソソーム膜に作用することによるリソソーム傷害が起こっていることがわかりました(図6C)。リソソームは脂質代謝において重要な役割を持つだけでなく、その障害によりリソソーム依存的細胞死(lysosome-dependent cell death:LCD)が起こることが知られています。細胞内に脂質を蓄積させることでリソソーム膜を安定化する化合物を用いて、修飾アデノシンによる毒性が有意に抑制されたことから、修飾アデノシンによる細胞死はリソソーム傷害によるものであることが示唆されました(図6D)。
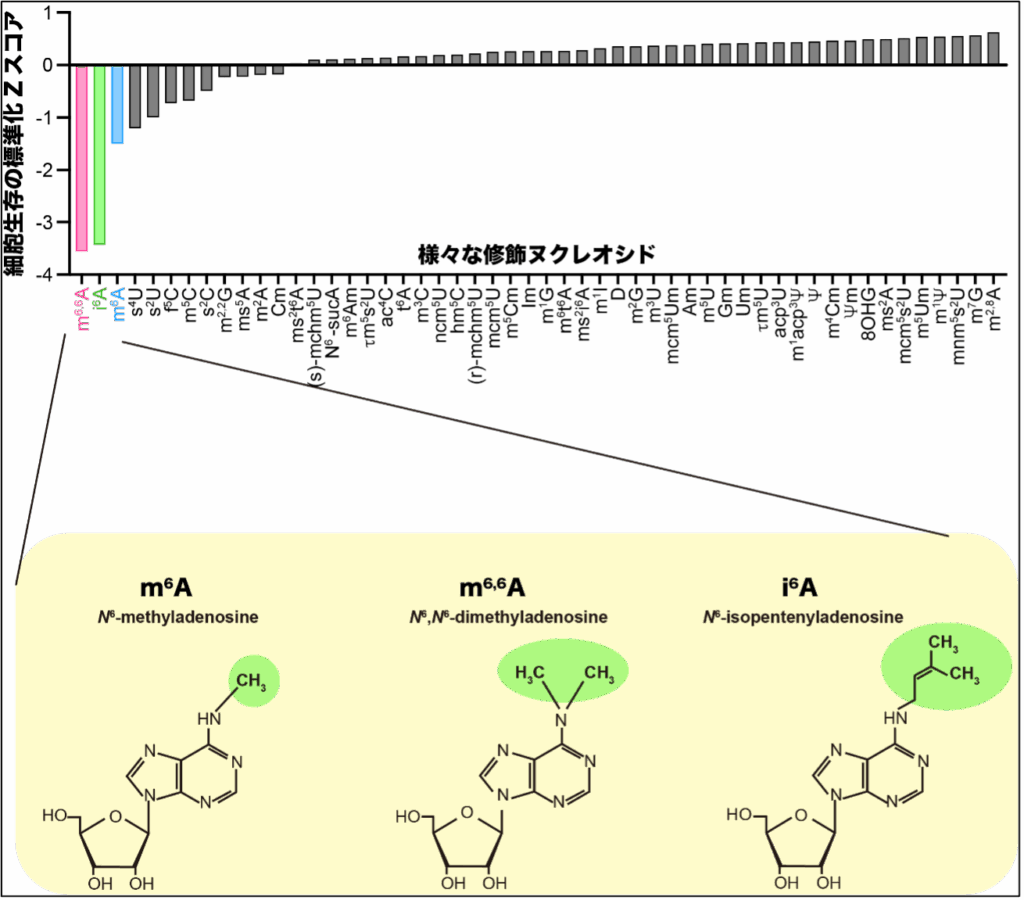
修飾ヌクレオシドをヒト培養細胞に投与した際の細胞生存を標準スコア化したもの。標準化Zスコアが大きいほど細胞が増殖していること、小さいほど細胞毒性があることを示す。その中で最も細胞毒性を示した3つの修飾ヌクレオシドであるm6A、m6,6A、そしてi6Aの構造式を示す。
今後の展開
本研究により、修飾ヌクレオシドのうち毒性を持つm6A, m6,6A, i6Aが、ADKとADALという2段階の代謝でIMPに無毒化されるという特異的な経路があること、この経路が破綻することで糖質や脂質などの代謝異常あるいはリソソームなどの細胞小器官の傷害が生じうることがわかりました。すなわち、この経路は生体にとって防御機構として機能しており、修飾ヌクレオシドに起因する新たな病態が明らかになったことになります。今後、修飾ヌクレオシドと疾患発症の関連性について、より深い理解が進むことが期待されます。
謝辞
本研究は、独立行政開発法人日本学術振興会(JSPS科研費22H02813、 22H04628、23K18088、20H00422、23H04748、21H04758、24H01322 、21H02659、21H05265、25H00007、25H00984、JP 22H04922 (AdAMS)、JP 16H06276 (AdAMS))、国立研究開発法人科学技術振興機構(JST) 創発的研究支援事業(FOREST; JPMJFR220K, JPMJFR205Y, JPMJFR205X)、同 戦略的創造研究推進事業 ERATO「鈴木RNA修飾生命機能プロジェクト」(研究総括:鈴木 勉、JPMJER2002)等の支援を受けて行われました。また、本論文は『東北大学2025年度オープンアクセス推進のためのAPC支援事業』の支援を受け、Open Accessとなっています。
用語説明
- 修飾ヌクレオシド:ヌクレオシドとは塩基と糖が結合した分子で、RNAの原材料の一つである。修飾ヌクレオシドとは、ヌクレオシドの塩基あるいは糖にメチル化やアセチル化などの修飾が施された分子である。 ↩︎
- m6A, m6,6A, i6A:アデノシンの構造に特定のメチル基などが付加された修飾ヌクレオシド。詳細な構造は図2を参照。 ↩︎
- IMP(inosine monophosphate):イノシンモノリン酸の略で、アデノシンが代謝分解されることでできる中間代謝産物。エネルギー代謝にも関与する。 ↩︎
- リソソームなどの細胞小器官:細胞内で特定の役割を担う構造体。リソソームは老廃物や不要物の分解を担う「細胞の清掃係」として知られる。 ↩︎
- 生理活性因子:生体内で情報伝達や機能調整を行う分子。ホルモンや神経伝達物質などが含まれる。 ↩︎
- アデノシンやATP:アデノシンは細胞内外での情報伝達に関与する物質。ATPは生体のエネルギー通貨として知られる分子。 ↩︎
- アデノシンA3受容体:アデノシンを認識し、細胞の反応を引き起こすタンパク質。主に細胞膜上に存在する。 ↩︎
- リン酸化:タンパク質などにリン酸基が付加される化学反応。細胞内シグナル伝達のスイッチとして働く。 ↩︎
- 脱アミノ化:アミノ基が分子から取り除かれる反応。代謝や無毒化過程で重要な役割を果たす。 ↩︎
- ホモロジーモデル:既知の類似タンパク質などの構造をもとに、未知のタンパク質構造を予測する方法。 ↩︎
- リガンド:受容体に結合して作用を引き起こす物質。 ↩︎
- 真核生物:細胞内に核をもつ動物。ヒトや哺乳類などが含まれる。 ↩︎
- 耐糖能異常:血糖値を正常に調節できなくなる状態。糖尿病やその予備群で見られる。 ↩︎
- アロステリック:酵素や受容体の活性が、活性部位とは異なる場所に結合した分子によって調節される現象。 ↩︎
- ミスセンス変異:DNAの「一文字」が別の文字に置き換わり、その結果タンパク質の中の1つのアミノ酸が違うものになる変化。これによりタンパク質の働きが変わり、病気の原因になることがある。 ↩︎
- ケミカルプロテオミクス:化学物質を用いて、細胞内のタンパク質の機能や相互作用を解析する研究手法。 ↩︎
- クリアランス:体内から不要物質を除去・分解する能力。主に肝臓や腎臓が関与する。 ↩︎
論文情報
論文名:Adenosine kinase and ADAL coordinate detoxification of modified adenosines to safeguard metabolism
著者:Akiko Ogawa1,2*, Satoshi Watanabe3, Iuliia Ozerova4, Allen Yi-Lun Tsai5,6, Yoshihiko Kuchitsu7, Harrison Byron Chong8, Tomoyoshi Kawakami1,9, Jirio Fuse1,9, Wei Han10, Ryuhei Kudo11, Tomoki Naito12, Kota Sato13,14, Toru Nakazawa13-18, Yasunori Saheki12, Akiyoshi Hirayama11, Peter F Stadler4, 19-24, Mieko Arisawa10, Kimi Araki25,26, Liron Bar-Peled8,27, Tomohiko Taguchi7, Shinichiro Sawa5,6, Kenji Inaba3, and Fan-Yan Wei1,2*
1)東北大学加齢医学研究所 モドミクス医学分野
2)東北大学大学院薬学研究科・薬学部 モドミクス薬学分野
3)九州大学 生体防御医学研究所
4)ライプツィヒ大学 バイオインフォマティクスグループ
5)熊本大学 生物環境農学国際研究センター(IRCAEB)
6)熊本大学 大学院 先端科学研究部
7)東北大学 大学院 生命科学研究科 細胞小器官疾患学分野
8)マサチューセッツ総合病院がんセンター
9)東北大学医学部 医学科
10)九州大学 大学院 農学研究院 農業薬剤化学研究室
11)慶應義塾大学 先端生命科学研究所
12)南洋理工大学 Lee Kong Chian医科大学
13)東北大学大学院医学系研究科 神経・感覚器病態学講座 眼科学分野
14)東北大学大学院医学系研究科 視覚先端医療学寄附講座
15)東北大学大学院医学系研究科 眼科画像情報解析学寄附講座
16)東北大学大学院医学系研究科 網膜疾患制御学寄附講座
17)東北大学大学院医学系研究科 ウェルビーイングデザイン共同研究講座
18)東北大学大学院医学系研究科 健康社会システム創造共同研究講座
19)マックス・プランク 数学科学研究所
20)ウィーン大学 理論化学研究所
21)コペンハーゲン大学 Center for Non-coding RNA in Technology and Health
22)コロンビア国立大学 理学部
23)サンタフェ研究所
24)ライプツィヒ大学SECAI/ScaDS.AI/iDiv
25)熊本大学 生命資源研究・支援センター
26)熊本大学 健康長寿代謝制御研究センター
27)ハーバード大学医学部 医学部門
*責任著者:
東北大学 薬学研究科 准教授 小川亜希子
東北大学 加齢医学研究所 教授 魏 范研
掲載誌:Cell
DOI:10.1016/j.cell.2025.07.041
URL:https://doi.org/10.1016/j.cell.2025.07.041
問い合わせ先
(研究に関すること)
東北大学加齢医学研究所 モドミクス医学分野
教授 魏 范研
大学院薬学研究科・薬学部
准教授 小川 亜希子
TEL:022-717-8562
Email:
fanyan.wei.d3*tohoku.ac.jp(*を@に置き換えてください)
akiko.ogawa.e5*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学加齢医学研究所 広報情報室
TEL:022-717-8443
Email:ida-pr-office*grp.tohoku.ac.jp(*を@に置き換えてください)
- 関連資料
- プレスリリース資料(PDF)


