不足した小腸機能を「ミニ臓器」で補う新たな再生医療コンセプトを実証 -脂質吸収の鍵「胆汁酸吸収機能」を付与し、短腸症候群モデルの生存率が改善-
2026.1.6 Tue
研究慶應義塾大学医学部医化学教室の遠藤龍眞研究員(東北大学大学院医学系研究科外科病態学講座小児外科学分野大学院生)、同内科学教室(消化器)の杉本真也助教、同医化学教室の佐藤俊朗教授らの研究チームは、上皮を支持する土台である間質を損傷せずに小腸の上皮だけを剥がしてオルガノイド1を移植することで、特定の吸収機能を付与した小腸を高い効率で作製する技術を開発しました。さらに、この技術が短腸症候群2モデル動物に対して治療効果を持つことを示しました。本成果は、難治性腸疾患に対する細胞移植による再生医療の実現に向けて、大きな前進となることが期待されます。
短腸症候群をはじめとする多くの難治性腸疾患の根本的治療は小腸移植ですが、小腸の提供者(ドナー)不足や拒絶反応などの課題が残されています。そのため、再生医療がその代替療法として開発されることが期待されており、オルガノイドを用いた上皮移植の研究も進められてきました。しかし、従来法では生着率が低く、移植上皮が十分な吸収機能を備えているかどうかを直接的に示すことができず、臨床応用へ向けた大きな障壁となっていました。
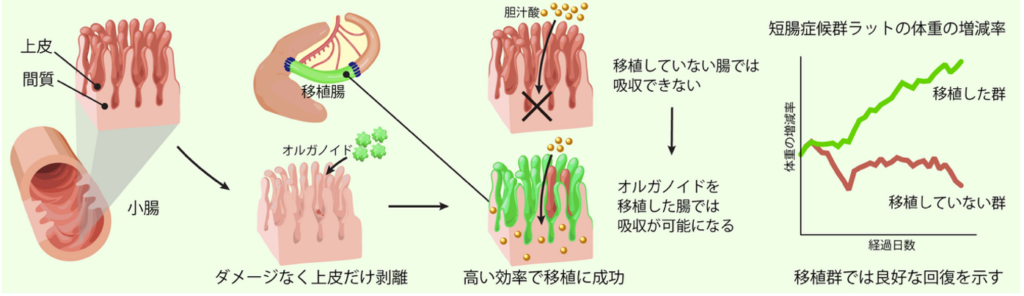
今回、本研究チームは、移植時に間質を保つ重要性に着目し、生着率を飛躍的に向上させることに成功しました。その結果、脂質の取り込みに欠かせない胆汁酸を吸収する、小腸の後半部分である回腸の機能を小腸の前半部分である空腸に構築し、世界で初めて吸収機能が備わっていることを直接的に実証しました。さらに、本技術を用いて回腸を切除したラット短腸症候群モデルに治療を行い、病態とともに生存率を改善することも示しました(図1)。本研究により、短腸症候群をはじめとした多くの難治性腸疾患に対して、腸の機能を作り変える再生医療の実現に向けた大きな一歩が踏み出されました。
本研究の詳細は、2025年12月29日(米国東部時間)に米科学誌Cell Stem Cell電子版に掲載されました。
研究の背景と概要
<必要とされている再生医療>
短腸症候群は、小腸の大部分が手術などで切除されることで、栄養や水分を十分に吸収できなくなる難治性疾患です。通常の食事だけでは必要な栄養をまかなえず、多くの患者がチューブを通じて静脈から栄養を補う中心静脈栄養に頼らざるを得ません。そのため、生活の質が大きく損なわれるだけでなく、経静脈カテーテル感染症や肝機能障害などの重篤な合併症によって、生命に危険が及ぶこともあります。腸管を延長する手術や、栄養吸収面積を広げる薬剤など、生命を支える上で重要な治療法は存在しますが、根治的治療は他人の小腸を移植する小腸移植しかないのが現状です。しかし、ドナーが慢性的に不足していることに加え、拒絶反応や長期的な治療成績が良くないといった問題もあり、すべての患者に実施できる治療とは言えない状況です。
こうした課題を背景に、近年では患者の腸組織を採取して、幹細胞から立体的な「腸オルガノイド」を作製し、それを移植して新しい腸の粘膜を再構築する技術が発展してきました。杉本真也助教、佐藤俊朗教授らの研究グループは、これまでに大腸の上皮を小腸オルガノイドに置き換え、「小腸化大腸」を作り出すことで短腸症候群モデルラットの病態を改善できることを報告しています(Sugimoto et al. Nature 2021)。しかし、このコンセプトは大腸を切除している患者には適用できず、技術的にも移植効率が低いこと、さらに移植された上皮が実際に十分な吸収機能を発揮しているかどうかは未解明であるといった問題が残されていました。
<必要な機能を腸上皮に付与する>
小腸は十二指腸、空腸、回腸の三つの領域から構成され、その中でも回腸は他の部位にはない特殊な働きを担っています。なかでも重要なのが「胆汁酸の吸収」です。胆汁酸は脂質を効率よく取り込むために不可欠であり、回腸がどれだけ残っているかは短腸症候群の予後を左右する重要な因子とされています。しかし、病変部位や手術上の事情から、回腸を温存できない患者も少なくありません。
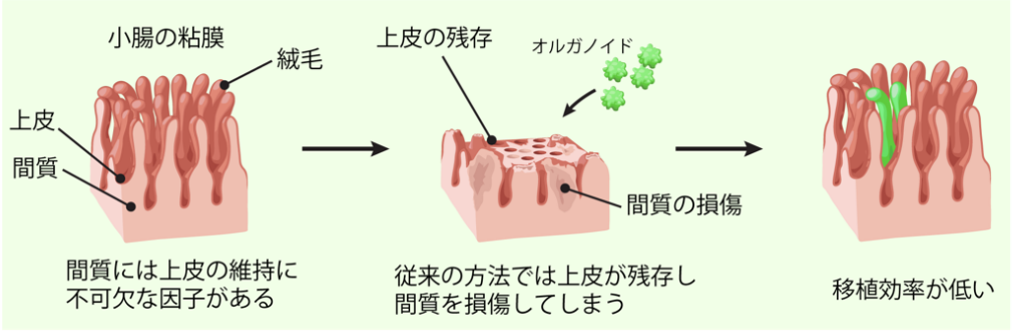
そこで今回、研究チームは、空腸しか残っていない患者でも回腸の機能を新たに獲得できれば、病態の改善につながる可能性があると考えました。しかし、前述の小腸化大腸と同じ手法をそのまま転用しても空腸の十分な「回腸化」を実現することは容易ではありませんでした。オルガノイドを移植して上皮を置き換えるためには、移植先の腸の上皮を完全に除去する必要があります。これまでは薬剤とブラシを用いて上皮をこすって取り除く手法が用いられてきましたが、この方法ではある程度の移植は可能なものの、効率が高いとは言えませんでした。さらに、平坦な大腸と違い、小腸の上皮は絨毛(じゅうもう)と呼ばれる多数の突起構造が密集しており、この複雑な構造ゆえに上皮だけをきれいに除去することが特に難しいという問題がありました。従来法で移植効率が低かった理由としては、上皮が完全に取り切れない点だけでなく、上皮を支持する土台である間質が損傷してしまうことが大きな要因と考えられました(図2)。間質には細胞の増殖や機能維持を支えるさまざまな物質が含まれており、腸の正常な働きに欠かせない存在です。
そこで本研究グループは、間質を可能な限り傷つけず、移植の障害となる上皮だけを選択的に除去することこそが、オルガノイドを高効率に生着させる鍵になると考えました。
研究の成果と意義・今後の展開
<移植効率の大幅な向上>
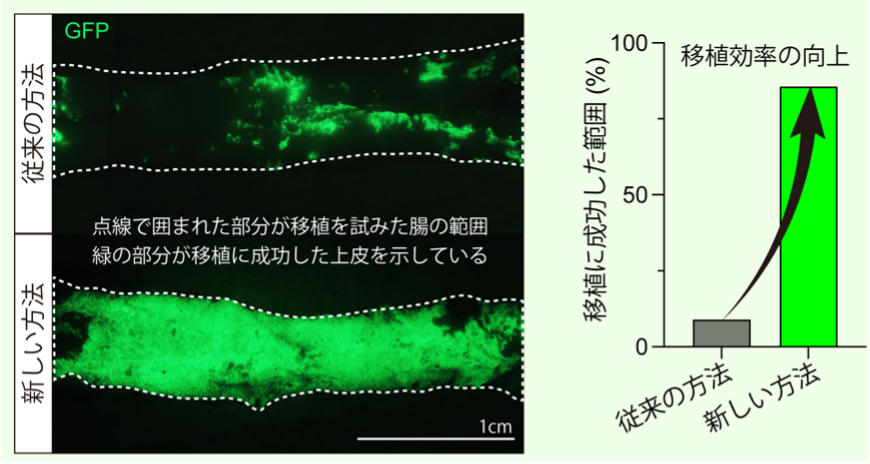
本研究ではまず、細胞間接着を断つ薬剤であるEDTAの作用を妨げている要因が、腸表面を覆い上皮を保護している粘液であることを明らかにしました。そこで、EDTAの効果を最大限に引き出すため、臨床でも使用されている粘液を柔らかくして溶かす薬剤であるN-アセチルシステインによる前処置とEDTAを組み合わせた、新しい上皮除去法を開発しました。この方法を用いることで、ラット小腸の粘膜上皮をほぼ完全に除去しながら、間質の構造や上皮の維持に必要不可欠な物質、筋肉や血管を破壊することなく良好に保てることを見いだしました。こうして土台が保たれた場所にオルガノイドを投与し、移植効率の向上について検証しました。
その結果、従来の間質が損傷される方法では移植効率が約10%にとどまっていたのに対し、新しい方法では約90%まで大幅に向上させることに成功しました(図3)。この成果により、臨床応用に不可欠である、広い面積に安定して上皮を移植できる道筋が拓かれました。
<移植オルガノイドの吸収機能を世界で初めて実証>
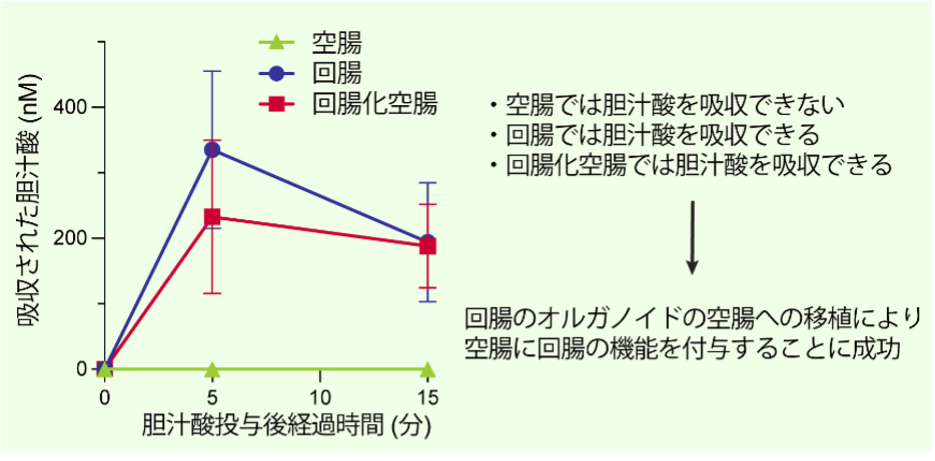
次に、移植したオルガノイドが実際に吸収機能を獲得しているかどうかを確認しました。従来は移植効率が低いため、吸収機能を生体内で直接解析することは困難でしたが、今回の大幅な移植効率の向上により、初めてその機能を評価できるようになりました。まず、ラットの空腸に回腸由来のオルガノイドを移植したところ、通常の空腸にはみられない胆汁酸吸収に関わるタンパク質が発現することを確認し、回腸の性質を持つ「回腸化空腸」の作製に成功しました。そしてこの回腸化空腸が本当に胆汁酸を吸収できるのかを評価しました。何もしていないラットの空腸と回腸のそれぞれに胆汁酸を投与すると、予想通り空腸では吸収が起こらず、回腸では吸収がみられました。続いて同じ方法で今回作製した回腸化空腸に胆汁酸を投与したところ、胆汁酸が確かに吸収されることが明らかになりました(図4)。
これらの結果から、オルガノイドを移植することで空腸に回腸本来の胆汁酸吸収機能を付与できることが示され、オルガノイドによって作られた上皮が、実際に吸収機能を持つことを世界で初めて直接的に実証することに成功しました。
<短腸症候群ラットモデルへの治療効果を実証>
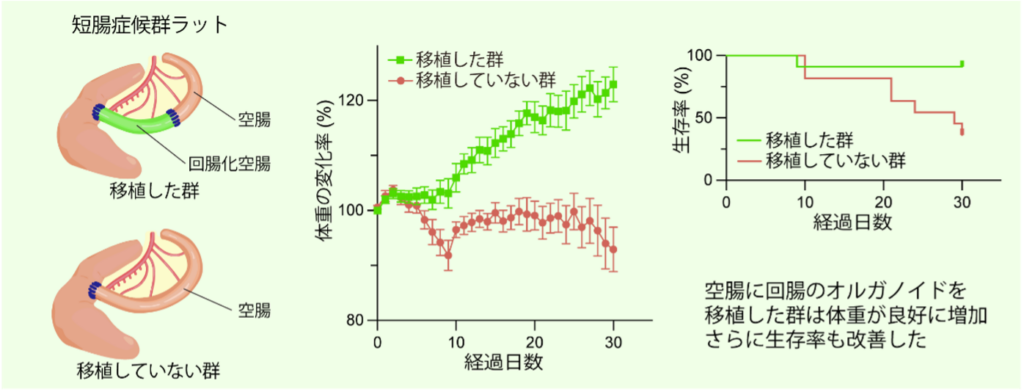
最後に、回腸の機能を付与した空腸が短腸症候群に対して治療効果を示すかどうかを検証しました。空腸しか残っていない短腸症候群ラットに回腸オルガノイドを移植した群と、移植を行わなかった群を比較したところ、移植群では体重が良好に増加し、生存率も有意に改善することがわかりました(図5)。オルガノイドは30日経過後も高効率に生着し続けており、オルガノイド移植によって実際に短腸症候群の病態とともに生存率を改善できることが示され、臨床応用に向けた重要な成果となりました。
<成果の意義と今後の展開>
本研究にはオルガノイドやオルガノイド移植に対する専門的な知識と技術が不可欠です。また、移植手技については、繊細な粘膜剥離操作や腸管の精緻な縫合・処置といった高度な外科技術を必要とするものであり、実臨床で培われた手術技術や小腸移植の視点と経験が重要となります。本研究は、短腸症候群をきたしうるクローン病などの炎症性腸疾患の豊富な診療経験を持ち、オルガノイド移植技術に精通した慶應義塾大学医学部内科学教室(消化器)の杉本真也助教、オルガノイドの開発者である同医化学教室の佐藤俊朗教授と、国内最多の小腸移植実績を有する東北大学の和田基教授のグループから参画した小児外科医の遠藤龍眞研究員らが連携する複合的なチームによって遂行されました。小腸移植診療で培われた「臨床の技術」と最先端の「オルガノイド研究」が融合した結果、今回の成果が初めて実現したといえます。
今後は、大動物モデルを用いた検証や、ヒト由来腸オルガノイドを用いた安全性・有効性評価が必要となります。また、今回検証したのは短腸症候群に対する治療効果ですが、オルガノイド移植治療の可能性はさらに広がっています。遺伝子編集技術との組み合わせや、異なる腸管部位のオルガノイドとの組み合わせなどにより、患者自身の細胞から作製したオルガノイドを用いて、不足する機能を補う個別化再生医療へ展開する可能性が期待されます。
特記事項
本研究は、日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療実現加速化プログラム「小腸オルガノイドを用いた再生医療へ向けた基盤的研究(研究代表者:杉本 真也)」、科学技術振興機構(JST)創発的研究支援事業「細胞固有の組織像から紐解く消化器病学(JPMJFR2458、研究代表者:杉本 真也)」、同戦略的創造研究推進事業 ERATO「佐藤オルガノイドデザインプロジェクト(JPMJER2303、研究代表者:佐藤 俊朗)」、日本学術振興会(JSPS)科研費JP23KJ0145, JP23K27665, JP22H04995)の支援によって行われました。
論文
英文タイトル:Niche-preserving transplantation promotes functional engraftment of intestinal organoids in rat short bowel syndrome
タイトル和訳:ニッチを保持した移植がラット短腸症候群において腸オルガノイドの機能的生着を促進する
著者名:遠藤龍眞、杉本真也、桑島佑太朗、股野麻未、羽生ひかる、高橋シリラット、加藤宏周、田中拓、Andreas Michael Sihombing、城崎浩司、旗野佳子、杉浦悠毅、金井隆典、和田基、佐藤俊朗
掲載誌:Cell Stem Cell
DOI:10.1016/j.stem.2025.12.007
用語説明
- オルガノイド:試験管内など生体外(in vitro)で、立体的に作られた組織の構造体です。「ミニ臓器」とも呼ばれています。 ↩︎
- 短腸症候群:さまざまな理由で小腸の大部分を切除したことなどにより、栄養素や水分を十分に吸収できなくなった状態です。 ↩︎
- 関連資料
- プレスリリース資料(PDF)


