ALS患者における血液脳関門破綻の解明につながる新たなモデルを開発! ~これまでとは全く異なる標的に対する新しい治療法開発への期待~
2024.12.13 Fri
研究発表のポイント
- iPS細胞技術を活用して、家族性ALS患者(TARDBP変異1)由来の脳微小血管内皮様細胞を作製し、バリア機能を詳細に検討しました。
- 家族性ALS患者が有する遺伝的背景が血液脳関門(Blood-brain barrier : BBB2)の異常につながることをヒトのモデルで初めて示し、ALSの進行にBBB破綻が関与する可能性を提示しました。
- ALSの病態に関する新しい知見として、この脳血管内皮細胞のバリア機能異常が炎症や神経細胞の損傷とは独立して起こっていることを証明しました。
- バリア機能異常の背景にBBBの発達・維持に重要なWnt/β-カテニンシグナルの低下があることを突き止め、同シグナル経路3の活性化でバリアが修復されることを確認しました。
概要
筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)は、運動機能を司る神経細胞が次第に壊れていく難治性の病気ですが、未だ有効な治療法がありません。近年の動物モデルを用いた研究によってその進行には脳を守るバリアである「血液脳関門(Blood-brain barrier:BBB)」の異常が関与していることが分かってきました。今回、山口大学大学院医学系研究科の西原秀昭助教らの研究チームは、慶應義塾大学、東北大学大学院医学系研究科の研究グループとの共同研究で家族性ALS患者由来のiPS細胞を使った新しいヒトBBB実験モデルを確立し、このバリア機能が家族性ALS患者のもつ遺伝的背景から影響を受ける可能性を明らかにしました。
この研究では、家族性ALS患者からBBBを構成する「脳微小血管内皮細胞(Brain microvascular endothelial cell:BMEC4)」をつくり、バリア機能を詳しく調べた結果、患者由来の細胞ではバリア機能に異常があり、外部からの有害物質が脳に侵入するリスクが高まることが確認されました。さらに、この脳血管内皮細胞のバリア機能異常は炎症や神経細胞の損傷とは独立して起こっており、ALSの病態に関する新しい知見を示すものです。
また、研究チームは、患者由来BMEC様細胞の異常を修復する方法として、「Wnt/β-カテニンシグナル」を活性化することで、バリア機能が改善されることを示しました。これにより、本モデルがALS患者におけるバリア機能異常に対する治療薬の探索にも有用であることが示され、新たな治療法の開発が進むことが予測されます。
本研究は、ALSにおけるBMECの役割を解明し、治療に向けた新しいアプローチを示した点で重要な成果です。この研究結果は、Frontiers in Cell and Developmental Biology誌に2024年8月15日付で掲載されました。
研究の背景
筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)は、運動神経が徐々に死滅していく進行性の神経変性疾患です。その中でも特定の遺伝子変異がALS発症に関与していることが知られており、ALSの病態を解き明かす手がかりと考えられています。これまでの研究は遺伝子変異と神経細胞の関連性に偏重してきましたが、未だ謎の多いALSの病態を解き明かすためには、神経以外の細胞における変異の影響についても研究が必要です。血液脳関門(Blood-brain barrier:BBB)は脳と血液の間に存在するバリアで、脳を保護し恒常性を維持する役割を担っています。このBBBは、脳微小血管内皮細胞(Brain microvascular endothelial cell:BMEC)を中心に構成されています。BMECはタイトジャンクション(細胞間の緊密な結合)を形成して、脳内への物質の通過を厳密に制御したり接着因子の発現を調整して免疫細胞が脳内に侵入することを制御しています。
本研究では、山口大学大学院医学系研究科の西原秀昭助教らの研究チームは、慶應義塾大学、東北大学大学院医学系研究科の研究グループと共同で、家族性ALS患者(TAR DNA Binding Protein:TARDBP 変異保有)から得られたiPS細胞を用いてBMEC様細胞を作製し、BMECの異常がどのようにALSの進行に関わっているかを調べました。
研究の成果
家族性ALS患者(TARDBP変異保有)由来のiPS細胞をBMEC様細胞に分化させた結果、健常者の細胞と比べ、タイトジャンクションの破綻が目立ち、バリア機能が有意に低下している(血液成分が脳内に漏れやすい)ことが確認されました。また、免疫細胞が脳に入り込む際に働く接着分子ICAM-1やVCAM-1の発現が増加し、より多くの免疫細胞を接着させる能力を有していることがわかりました。さらには、家族性ALS患者由来のBMEC様細胞ではALS患者で観察される病理所見に類似したTDP-43蛋白の異所性局在が観察されたことから、本モデルがALS患者のBMECを模していることが示されました。加えて、家族性ALS患者由来のBMEC様細胞において、BBBの発達・維持に重要であることが知られているWnt/β-カテニン経路の下流分子の発現が低下していることを見出しました。これらは先行する動物モデルを使用した報告やALS患者脳の遺伝子発現解析の結果とも一致していますが、実験室に患者由来モデルを再現し、ヒトでこの現象を確認した初めての報告です。本研究ではさらにWnt/β-カテニン経路を化合物によって活性化することで、ALS患者由来BMECのタイトジャンクションの破綻やVCAM-1の発現亢進が回復し、バリア機能が改善されることが確認されました。ヒトと動物ではBBB構成タンパクの発現が異なっており、今回、患者由来モデルを作製し、治療の可能性を示せたことは、より詳細なALS患者のバリア機能破綻の病態を解明する上で重要な報告といえます。
意義と展望
この研究は、家族性ALS患者(TARDBP変異保有)が生来的に血液脳関門(BBB)の脆弱性を有していることをヒトモデルで初めて示しました。実際の患者サンプルの採取が難しいBMECを、独自のiPS細胞技術を用いてモデル化し、病理所見と類似した表現型を再現することを示しました。ALS患者のBMEC機能研究とBBBを標的とした治療薬の探索に有用なモデルであり、BBBの修復による病状の進行抑制という新たな治療戦略がALSにもたらされることが期待されます。
用語説明
- TARDBP(TAR DNA binding protein):TARDBPは、RNA結合タンパク質であるTDP-43(TAR DNA binding protein 43)をコードする遺伝子で、ALSや前頭側頭型認知症などの神経変性疾患に関連する変異が知られています。TDP-43は細胞の核内に主に存在し、RNAのスプライシングや輸送などに関与し、その異常が神経細胞の機能不全を引き起こすと考えられています。ALS患者では細胞室内にTDP-43蛋白が異常に蓄積して凝集体を形成していることが知られています。 ↩︎
- 血液脳関門(Blood-brain barrier:BBB):血液脳関門は、脳の微小血管が有する恒常性維持を司る重要な機能です。外部の有害物質や病原体から脳内の神経細胞を守り、無秩序な免疫細胞の侵入を防ぐと同時に、中枢神経内の細胞に必要な栄養素を積極的に取り込む役割を果たしています。ALSのような神経変性疾患では、このバリアが破壊されることで病気の進行に影響を与えることが明らかになってきています。 ↩︎
- Wnt/β-カテニン経路:Wnt/β-カテニン経路は、細胞の発達や増殖、分化に関わるシグナル伝達経路で、BBBの発達・維持にも重要であることが知られています。 ↩︎
- 脳微小血管内皮細胞(Brain microvascular endothelial cell:BMEC):BMECはBBBの主要構成細胞であり、細胞間にタイトジャンクションを形成し、物質の脳内侵入を制限します。また、BMECは脳に必要な栄養素や物質を選択的に輸送する特異的トランスポーターを備えています。さらにICAM-1やVCAM-1といった細胞接着因子を発現し、免疫細胞の脳内侵入を制御しており、BBBの機能維持の中心的な役割を持つ細胞です。 ↩︎
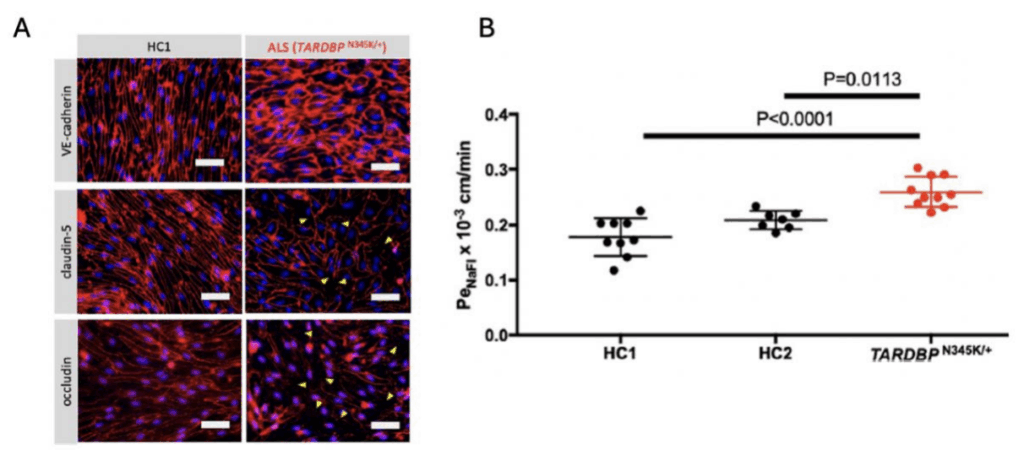
図1B:ALS患者由来BMEC様細胞は高い小分子透過性を示す。蛍光小分子を用いてBMEC様細胞のバリ機能(透過性)を測定。ALS患者(TARDBP N345K/+)由来の細胞は、健常者由来の細胞に比べて蛍光小分子の透過性が有意に高く、タイトジャンクションの破綻が機能的に現れている。
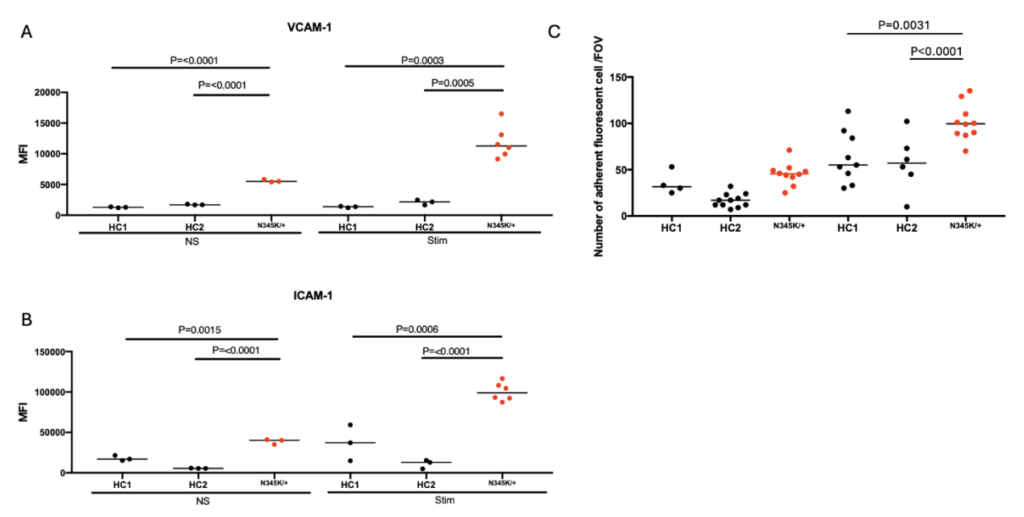
図2C:炎症性サイトカインの刺激(Stim)により、ALS患者由来のBMEC様細胞には、健常者由来の細胞よりも多くの免疫細胞が接着した。
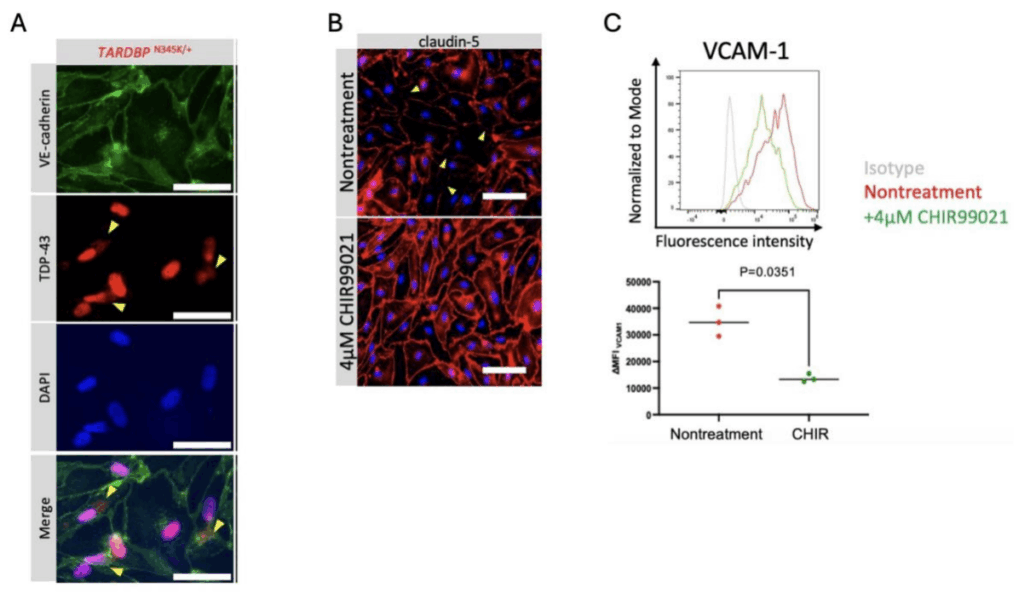
図3B:Wnt/β-カテニンシグナルの活性化剤CHIR99021の投与により、ALS患者由来のBMEC様細胞で破綻していた(黄色矢印)タイトジャンクション(claudin-5)が修復した。
図3C:CHIR99021の投与により、ALS患者由来の細胞表面で増加していたVCAM-1の発現が抑制された。
論文情報
論文名:Establishment of a novel amyotrophic lateral sclerosis patient (TARDBP N345K/+)-derived brain microvascular endothelial cell model reveals defective Wnt/β-catenin signaling: investigating diffusion barrier dysfunction and immune cell interaction.
掲載誌:Frontiers in Cell and Developmental Biology
著者:Matsuo K et al.
掲載日:2024年8月15日
DOI:10.3389/fcell.2024.1357204
謝辞
本研究は、上原記念財団、JSPSスイスとの国際共同研究プログラム(グラント番号JPJSJRP20221507)、卓越研究員制度、科研費(グラント番号22K15711)、創発的研究支援事業(グラント番号JPMJFR2269)、国立研究開発法人日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療実現加速化プログラム(グラント番号JP23bm1423008)、AMED再生・細胞医療・遺伝子治療実現加速化プログラム筋萎縮性側索硬化症における病態回避機構の解明と治療に資する層別化技術開発、再生・細胞医療・遺伝子治療実現加速化プログラム革新的RNA編集技術を用いた筋萎縮性側索硬化症の遺伝子治療開発、脳とこころの研究推進プログラム孤発性筋萎縮性側索硬化症の双方向トランスレーショナル研究による病態介入標的の同定と核酸医薬の開発研究、「ゲノム創薬基盤推進研究事業RNA標的医薬創出に資する、疾患RNA分子完全長一次構造に関するデータ基盤の構築」、難治性疾患実用化研究事業患者レジストリを活用した沖縄型神経原性筋萎縮症のエビデンス創出研究、武田COCKPITRファンディング、2022 iPSアカデミアジャパングラント、ライフサイエンス振興財団、加藤記念バイオサイエンス財団、宮田幸比古記念ALS研究財団、武田科学振興財団、JSPS科研費JP20H00485, JP21H05278, JP22K07500, JP22K15736の支援を 受けました。
- 関連リンク
- 詳細(PDF)


