悪性黒色腫(メラノーマ)の第Ⅲ相医師主導治験の開始について
2025.2.19 Wed
がん発表のポイント
- 悪性黒色腫(メラノーマ)1に対する既存治療は重篤副作用の発現頻度が高く、主要な治療薬である免疫チェックポイント分子阻害薬(抗体医薬)2は高額で注射薬(利便性が悪い)であることから、副作用が無く、奏効率を上昇させる内服薬の開発が待ち望まれています。
- PAI-1(プラスミノーゲンアクチベーターインヒビター1)阻害薬3TM5614は、探索から最適化、非臨床GLP試験4、GMP合成・製剤化5、第Ⅰ相〜第Ⅲ相試験(医師主導治験)まで一貫して東北大学で開発された日本発の医薬品(内服薬)です。今回の薬事承認申請のための第Ⅲ相試験も企業治験ではなく、医師主導治験で実施するアカデミア発創薬の初めてのモデルです。
- TM5614は、2024年8月に厚生労働省から「悪性黒色腫に対する希少疾患医薬品指定」を受けています。
- 免疫チェックポイント分子阻害薬である抗PD-1抗体が効かない難治性悪性黒色腫に対して、日本医療研究開発機構(AMED)の助成金でTM5614の安全性・有効性を検討する医師主導治験(第Ⅱ相治験)を行い、有効性と安全性を確認しました(参考論文)。
- 2025年2月3日に東北大学病院にて最初の患者が登録され、2月18日から投与が開始され、薬事承認のための医師主導治験(第Ⅲ相試験)が始動しました。
概要
東北大学病院は、PAI-1阻害薬TM5614の悪性黒色腫(メラノーマ)の第Ⅲ相試験において、最初の被験者を登録し、治験を開始しました(研究代表者は東北大学病院皮膚科 准教授 藤村卓)。本医薬品は、探索から最適化、非臨床GLP試験、GMP合成・製剤化、第Ⅰ相〜第Ⅲ相試験(医師主導治験)まで一貫して東北大学で開発された日本発の医薬品(内服薬)であり、今回の薬事承認申請のための第Ⅲ相試験も企業治験ではなく、医師主導治験で実施するアカデミア発創薬の初めてのモデルです。
悪性黒色腫患者の罹患率は国内では10万人に1.5~2人と少なく、国内の総患者数は約5,000 人の希少疾患ですが、米国では10万人あたり21.0人、有病者数は 1,413,976人と多い皮膚がんです。
抗PD-1抗体ニボルマブ6などの免疫チェックポイント阻害薬の登場で、悪性黒色腫の治療は大きく改善しました。さらに、抗CTLA-4抗体イピリムマブ7が開発され、抗PD-1抗体単独での奏効率(2割程度)を高める併用療法も実施されています。しかし、自己免疫疾患の重篤副作用のため単剤投与に比べて投与中止の発現頻度は4倍と高く、さらに高額医療費の課題もあるため、副作用が無く、奏効率を上昇させる内服薬の開発が待ち望まれています。PAI-1阻害薬TM5614は第Ⅱ相医師主導治験において、治療開始8週時点における奏効率は25.9%(7/27例、治験薬8週投与完了患者、PPS評価)であり、病勢制御率(CR+PR+SD)では66.7%でした。
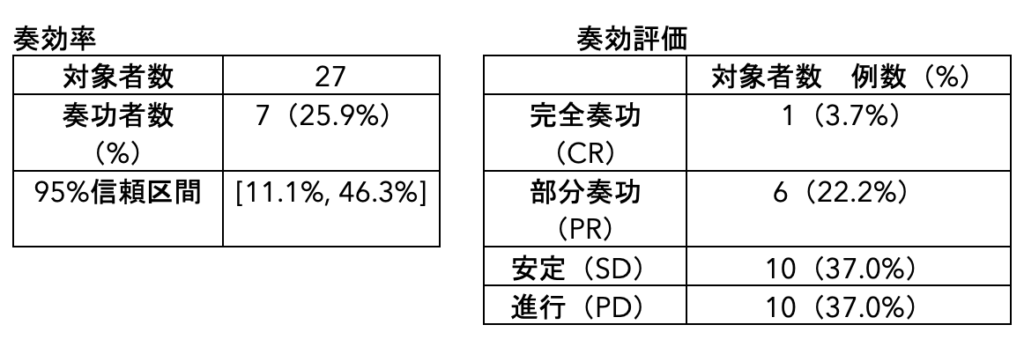
主要評価項目である8週併用時点の奏効率(CR+PR:25.9%)は、既に承認されている治療であるニボルマブ+イピリムマブ併用のヒストリカルコントロールの奏効率(13.5%)に対して優れた成績を得ています。特筆すべきは、その併用期間が2ヶ月と短期間であるにも関わらず、二次治療としてのニボルマブ+イピリムマブ併用療法の奏効率(13.5%)を大幅に上回る結果であったことです。さらに、ニボルマブ+TM5614併用は、ニボルマブ無効例において生じた重篤な有害事象は7例7件で、治験薬との因果関係の可能性があるのが肝機能障害2件と少なく、ニボルマブ+イピリムマブ併用より安全性が高いことが示されています。
本第Ⅲ相試験は、根治切除不能悪性黒色(メラノーマ)患者124例を対象に、ニボルマブとのTM5614の併用の有効性及び安全性を検証する第Ⅲ相ランダム化プラセボ対照二重盲検医師主導治験8であり、東北大学病院など国内18施設(東北大学病院、札幌医科大学附属病院、弘前大学医学部附属病院、自治医科大学附属さいたま医療センター、国立がん研究センター東病院、国立がん研究センター中央病院、がん研究会有明病院、新潟県立がんセンター新潟病院、静岡県立静岡がんセンター、名古屋市立大学病院、筑波大学附属病院、岐阜大学医学部附属病院、島根大学医学部附属病院、愛媛大学医学部附属病院、九州大学病院、九州がんセンター、熊本大学病院、鹿児島医療センター)で実施されます。
用語説明
- 悪性黒色腫(メラノーマ): 本邦で最も多い皮膚がんであり10万人に1.12人発症している。進行するといまだ高い死亡率を示す。欧米では日本の30倍から50倍の発症率であり、海外では健康診断項目にも含まれる疾患である。 ↩︎
- 抗PD-1 抗体(免疫チェックポイント阻害薬):オプジーボ、キイトルーダとして進行期メラノーマ治療に幅広く使用されている。 ↩︎
- PAI-1(プラスミノーゲンアクチベーターインヒビター1):古くは血管新生に、最近は免疫チェックポイントの発現に関与することが知られている。いずれも癌の進行に深く関わることから、癌の進行に直接関わる因子として30年前から研究されている。PAI-1阻害薬TM5614:東北大学で開発した新規薬剤。 ↩︎
- 非臨床GLP試験:医薬品の安全性に関する非臨床試験において、GLP(Good Laboratory Practice)基準に従って実施される試験。GLP基準は、試験施設の運営管理や試験設備、試験計画、内部監査体制などを確認する基準である。 ↩︎
- GMP合成・製剤化:医薬品を安全・安心に製造するために、Good Manufacturing Practice(適正製造規範)に基づいて原薬や製剤を製造・管理することである。GMP合成・製剤化では、原料の受入れから最終製品の出荷に至るまでの全工程において、品質管理と製造管理が実施される。 ↩︎
- ニボルマブ:プログラム細胞死1(PD-1)という免疫チェックポイント分子を標的とする抗体医薬(ヒト型抗ヒトPD-1モノクローナル抗体)で、免疫系の抑制解除による抗がん作用を狙った医薬品。 ↩︎
- イピリムマブ:細胞傷害性Tリンパ球抗原-4(CTLA-4)という免疫チェックポイント分子を標的とする抗体医薬(ヒト型抗ヒトCTLA-4モノクローナル抗体)で、ニボルマブとは異なる標的の免疫チェックポイント阻害薬。 ↩︎
- プラセボ対照二重盲検医師主導治験:対象患者を無作為に、治験薬を投与する群と対照薬(プラセボ)を投与する群に分け、医師も患者もどちらが投与されるかを知らない条件で、両群同時に薬を投与する臨床試験方法であり、医師が効果の期待される患者に対して治験薬を投与するなどの機会を減らし、効果があるはずといった先入観が評価に反映される可能性や、患者が知った場合もその処置への反応や評価に影響が生じることを避けるための試験方法。 ↩︎
参考論文
タイトル:Phase II,multicenter study of plasminogen activator inhibitor-1 inhibitor (TM5614) plus nivolumab for treating anti-PD-1 antibody-refractory malignant melanoma: TM5614-MM trial.
著者:Taku Fujimura, Koji Yoshino, Hiroshi Kato, Satoshi Fukushima, Shoichiro Ishizuki, Atsushi Otsuka, Shigeto Matsushita, Ryo Amagai, Yusuke Muto, Emi Yamazaki, Yumi Kambayashi, Takashi Yahata, Toshio Miyata, Yasuhiro Fujisawa, Yoshihide Asano
責任著者:東北大学大学院医学系研究科皮膚科学分野 准教授 藤村 卓
掲載誌:British Journal of Dermatology
DOI:10.1093/bjd/ljae231
URL: https://doi.org/10.1093/bjd/ljae231
問い合わせ先
(研究に関すること)
東北大学大学院医学系研究科 皮膚科学分野
准教授 藤村 卓
TEL:022-717-7271
E-mail:taku.fujimura.e3*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院医学系研究科・医学部広報室
東北大学病院広報室
TEL:022-717-8032
E-mail:press.med*grp.tohoku.ac.jp(*を@に置き換えてください)
- 関連資料
- 詳細(PDF)


