脳内エネルギーのダイナミクス てんかん発作時の代謝分子動態の解析を通して
2025.3.24 Mon
研究発表のポイント
- 生存に必須のエネルギー源ATP1濃度は一定と考えられていましたが、てんかん2発作に伴い、マウスの神経細胞内ATPは大きく減少しました。
- 初めてのてんかん発作時、細胞内ATPはてんかんの突然死3時の半分ほどまで減少し、過剰な代謝的負荷が生じました。
- てんかん発作時、アストロサイト4内のピルビン酸5が増加しました。これにより、アストロサイトからのエネルギー供給が減少し、アストロサイト内でピルビン酸が貯留し、神経細胞内ATPが減少することが示唆されました。
- 発作を繰り返すと、さらに過剰なてんかん様神経発振が見られる一方で、神経細胞内ATPの減少幅はむしろ小さくなりました。これは、血流量の増加によって神経細胞へのエネルギー供給が増えるためだと考えられます。
概要
細胞エネルギー源であるATPは生存に必須であり、その濃度は通常大きく変動しないと考えられてきました。東北大学大学院生命科学研究科の古川孝太大学院生と松井広教授(大学院医学系研究科兼任)らのグループは、てんかん発作による代謝的負荷をかけた際のマウス神経細胞内ATP、アストロサイト内ピルビン酸、および血流量の変動を解析し、脳内でのエネルギーの流れを決定する要因を探ることに挑戦しました。研究グループは、ATP、ピルビン酸、血流量に対する蛍光センサー6を用いた新規解析法を開発し、マウスの脳内エネルギーのダイナミクスを調べました。その結果、てんかん発作時に神経細胞内ATPが大きく減少し、神経細胞へのエネルギー供給が一過性に遮断される可能性が示唆されました。脳内エネルギーの供給と消費のダイナミクスを解析することで、脳の情報処理を支える仕組みが解明され、脳病態の治療戦略の開発につながることが期待されます。
本成果は2025年3月20日付でJournal of Neurochemistry誌に掲載されました。
詳細な説明
生物が生きていくためには、エネルギー源であるATPの濃度が細胞内で適切に保たれている必要があります。細胞内部ではカリウムイオンの濃度が高く、外部ではナトリウムイオンの濃度が高くなっています。この不均等なイオンバランス7を維持するためにATPのエネルギーが消費されています。このATPは、主にグルコース8と酸素をもとに細胞内で産生されます。脳は全体重のわずか2%の重さしか占めませんが、筋肉のように力学的エネルギーをほとんど使用しないにもかかわらず、全身のグルコースの約20%を消費します。これは、神経細胞内外のイオンバランスを不均衡に維持するために多くの代謝エネルギーを脳が消費しているためと考えられています。また、脳は供給されるエネルギーを効果的に活用し、意識を維持するとともに、知覚・認知・記憶・判断などの高度な情報処理を行っています。これらの機能の一部は、現代のコンピュータに匹敵し、場合によっては凌駕するほどの性能を持っています。脳内のエネルギー供給と消費のダイナミクスを解明することで、生物特有の脳内情報処理9のメカニズムを明らかにできることが期待されます。
本研究では、マウスを用いて、脳内にてんかん様の過剰な神経発振という代謝的な負荷をかけることで、「代謝と神経回路の動作原理」を探ることに挑戦しました。対象とする系に対して摂動を加え、その影響を計測することで内部状態を理解する方法は、脳のような超複雑系を研究する上で有効です。この手法は、すべての実験科学で一般的に用いられるアプローチと言えます。本研究では、てんかん発作や突然死といった極端な状態において、血管・アストロサイト・神経細胞を伝わる代謝エネルギー分子の動態を解析しました。これにより、脳内エネルギーのダイナミクスを規定する基本原理の解明を目指しました。
今回の取り組み
東北大学大学院生命科学研究科 超回路脳機能分野の古川 孝太(ふるかわ こうた)大学院生、生駒 葉子(いこま ようこ)助教、松井 広(まつい こう)教授(大学院医学系研究科、兼任)らのグループは、理化学研究所、東京科学大学、ライプツィヒ大学(ドイツ)との国際共同研究を実施しました。本研究では、生きたマウスの海馬領域に光ファイバーと刺激電極を埋め込み、電気刺激によっててんかん様神経発振を誘発しました。その際のエネルギー分子の動態を解析し、脳内の代謝メカニズムを探りました。
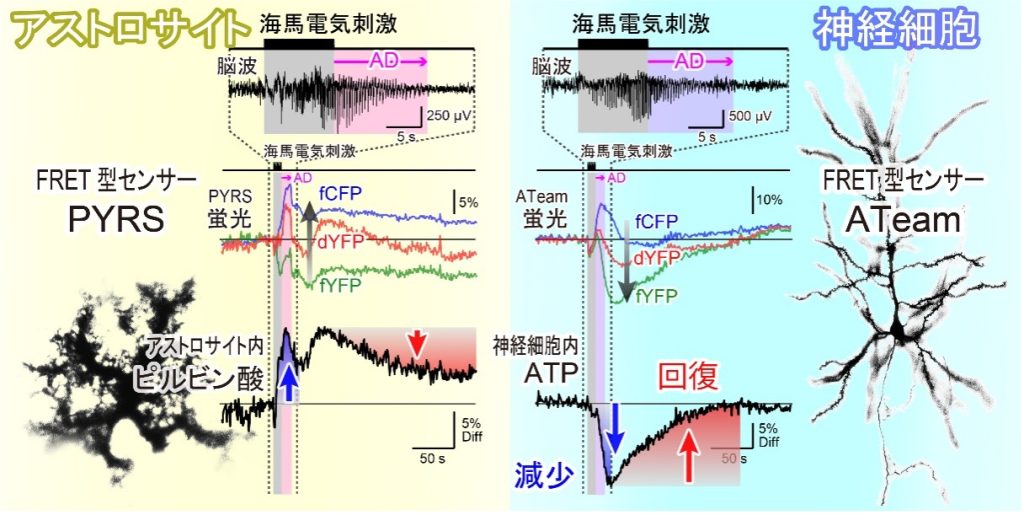
本研究では、脳内のエネルギー分子動態を計測するために、ファイバーフォトメトリー法10を使用しました。この手法では、ターゲットとする生体分子の濃度に応じて蛍光が変化するセンサータンパク質を導入し、生体内の特定の臓器に光ファイバーを埋めこみます。ファイバーを介して励起光を照射し、生体内で発生した蛍光信号を検出することで、目的の分子の濃度動態を測定できます。ファイバーフォトメトリー法を用いることで、脳の深部の生体情報を生きた状態で取得できるうえ、長期間の計測も可能になります。本研究では、神経細胞特異的に蛍光ATPセンサー(ATeam)11を発現させたマウスと、アストロサイト特異的に蛍光ピルビン酸センサー(PYRS)12を発現させたマウスを用いて実験を行いました。
本研究では、光ファイバーとともに海馬に挿入した2本の電極を用いて電気刺激を与え、てんかんモデルマウスを作製しました。電気刺激を行うと、刺激終了後もしばらくの間、自律的に継続する、ヒトのてんかん患者で観察されるようなてんかん様の神経発振(after discharge; AD)が記録されました。さらに、この電気刺激を数日にわたって繰り返すことで(キンドリング)、てんかん発作の増強現象を捉えることができました。これらの結果から、本モデルがてんかん発作の病態解析に適していることが示されました。
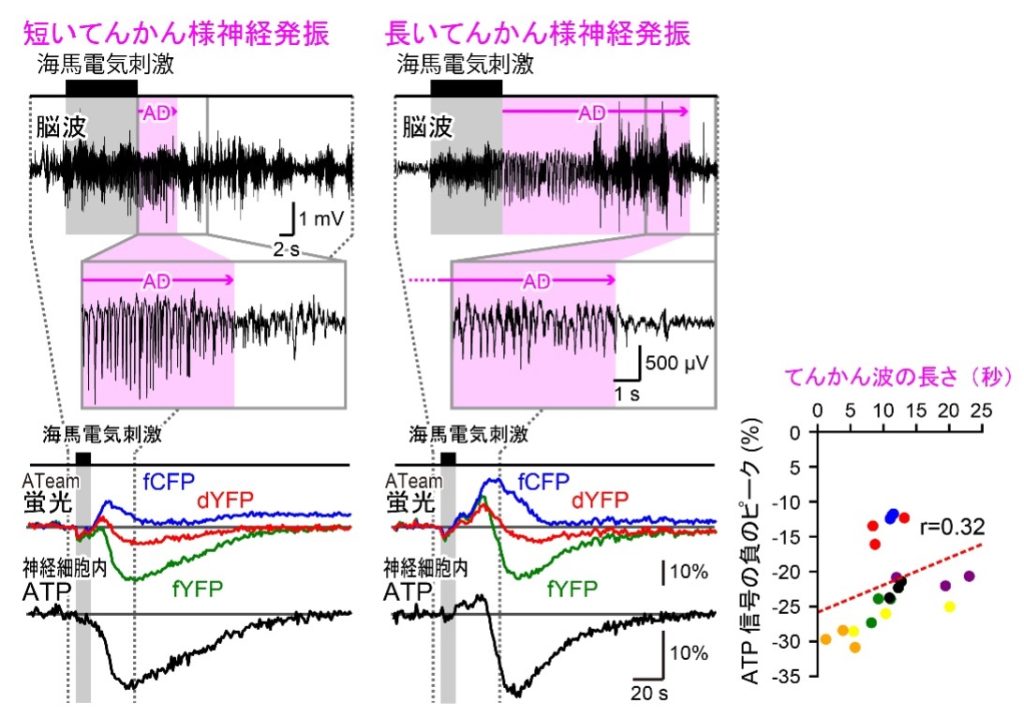
電気刺激によっててんかん様の神経発振が引き起こされると、神経細胞内で大幅なATPシグナルの減少が記録されました。本研究では、同じ強度の刺激に対して、試行ごとにさまざまな長さのADが観測されましたが、ATPシグナルの減少幅にはほとんど変化が見られませんでした。神経細胞では、ATPが最も消費されるプロセスとして、活動電位の発生(神経発火)によって崩れたイオンバランスを回復させるNa+/K+ポンプの駆動が知られています。しかし、本実験の結果は、この既知のメカニズムでは説明できない可能性を示唆しています。
そこで、以下の仮説が考えられました。
1)ATPの大量消費をともなう他のメカニズムの関与:神経発火以外の過程でATPが著しく消費されている可能性があります。
2)エネルギー供給の制限:グルコースや酸素供給の不足などにより、エネルギー供給が大幅に制限され、ATPレベルが顕著に低下している可能性も考えられました。
記録された蛍光シグナルの分析から、てんかん様神経発振が引き起こされる際に脳血流に変化が生じている可能性が示唆されました。血液に含まれるグルコースと酸素はATP産生に不可欠な分子であるため、血流の変化がエネルギー供給に与える影響は重要であると考えられます。そこで、血流量の変化を直接調べるために、血管内に蛍光色素を注入し、蛍光シグナルを観察しました。その結果、てんかん様神経発振時には血流量が減少していることを示す蛍光シグナルが記録されました。この結果は、血管からのエネルギー供給が制限されている可能性を示唆しており、これが神経細胞でのATP濃度の著しい低下を引き起こす要因になっている可能性があることを示しています。
続いて、脳内のエネルギー代謝において重要な役割を担うアストロサイトの細胞質におけるピルビン酸動態を調べました。その結果、電気刺激によって引き起こされるてんかん様神経発振の際に、アストロサイト内のピルビン酸濃度が増加することが示されました。通常、アストロサイトは血管からグルコースを取り込み、それをピルビン酸に代謝した後、乳酸に変換してモノカルボン酸トランスポーター(MCT)を介して細胞外に放出します。放出された乳酸は神経細胞に取り込まれ、ATP産生に利用されます。アストロサイトにおけるピルビン酸濃度の増加は、以下の要因に起因している可能性があります。
1)MCTの輸送効率低下:乳酸の細胞外輸送が抑制され、ピルビン酸が細胞内に蓄積した可能性があります。
2)アストロサイト自身のエネルギー代謝効率の低下:ミトコンドリアでの代謝が滞り、ピルビン酸が異常に蓄積している可能性も考えられました。
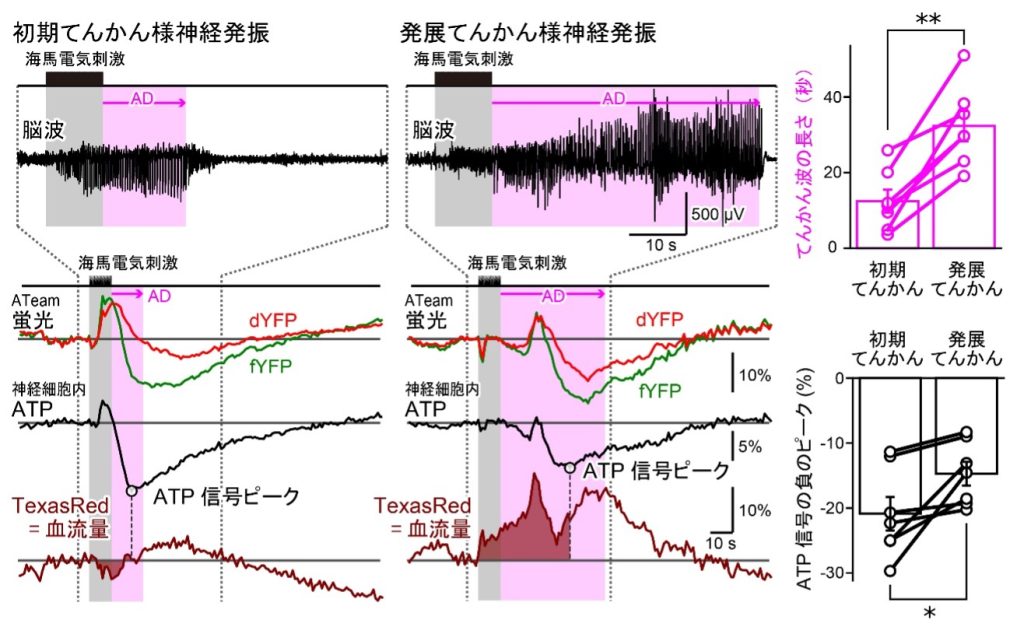
数日間にわたり電気刺激を繰り返すと、てんかん発作の激しさが増し、神経発振の持続時間も延長することが観察されました。一方で、神経細胞内のATPシグナルの減少量は次第に小さくなる傾向が見られました。発作の進行にともなう血流量の変化を調べた結果、発作初期に比べ、発作が発展した後では血流量の増加が観測されました。このことは、発作の進行にともない、血液を介して神経細胞へのエネルギー供給量が増加していることを示唆しています。これらの結果から、神経細胞内のATP濃度の変動は、発作時のエネルギー消費量だけでなく、血流を介したエネルギー供給量にも大きく依存していることが示唆されました。血流量の調節は、てんかん発作時の神経細胞のエネルギーバランスを維持するうえで、重要な役割を果たしている可能性があります。
電気刺激を繰り返しててんかん発作を発展させた結果、ごく稀に、てんかんの突然死(SUDEP)が引き起こされることがありました。SUDEPはヒトのてんかん患者にも発生し、実際、てんかん関連死の中で最も多いことが知られています。しかし、これまでその根本的な原因や予防策はほとんど明らかになっていませんでした。その理由として、SUDEP発生時に脳波などがモニタリングされることがほとんどないためです。本研究では、マウスモデルにおいてSUDEPの発生が記録され、神経細胞の細胞質ATPシグナル動態を詳細に解析するユニークな機会を得ました。細胞死とともに細胞呼吸の生化学的プロセスは停止し、その結果、細胞ATP濃度は減少すると考えられます。実際、マウスのSUDEP時には神経細胞の細胞質ATPシグナルが大幅に低下しました。このことから、本研究を通して、ATPセンサーとしてのATeamの機能が生体内で確認されたと言えます。また、てんかんの初期段階における発作にともなうATPシグナルの平均減少量は、SUDEPで観察された減少の最大55%にも達することが示されました。つまり、てんかん様神経発振は神経細胞にとってかなりの代謝的負担となっていることが示唆されました。
まとめ
以上の研究では、てんかん様神経過活動に伴う神経細胞質内ATP濃度の大幅な減少が観察されました。しかし、このATP減少が神経発火に伴うATP消費の直接的な結果ではない可能性が示唆されました。そこで、血管の血流動態を測定した結果、血流動態の変化がエネルギー供給を通じて神経細胞質ATPレベルを制御している可能性が明らかとなりました。さらに、てんかん様神経過活動時におけるアストロサイト細胞質内のピルビン酸動態を調べたところ、ピルビン酸濃度の増加が確認されました。この増加の背景には、乳酸やピルビン酸を細胞外へ排出するトランスポーターの輸送効率低下が関与している可能性が考えられました。また、神経細胞のATP産生がアストロサイト由来のエネルギー基質に依存している場合、アストロサイトからの乳酸放出の一時的な抑制が神経細胞内ATPレベルの低下を引き起こしている可能性も示唆されました。これらの結果から、神経細胞のATP動態には、血管の収縮や拡張によるエネルギー供給の変化、さらにアストロサイトを介したエネルギー供給路の可塑的変化が関与していることが示されました。本研究を通じて、てんかん時の過剰な代謝負荷が脳内エネルギーバランスに与える影響が明らかにされ、脳内エネルギー制御のメカニズムの存在が示唆されました。
今後の展開
生物の脳は、コンピュータと比較してはるかに少ないエネルギーで効率的に情報処理を行うと考えられています。本研究では、生物の脳における代謝エネルギー動態の制御メカニズムを解明し、生物らしい情報処理を支える仕組みの理解を深めることを目指しました。具体的には、てんかん発作によって脳に代謝的な負荷をかけた際、代謝エネルギー分子の動態がどのように変化するかを検証しました。その結果、血管からのグルコースや酸素の供給、アストロサイトから神経細胞への乳酸などの代謝分子の受け渡しが律速段階であることが明らかになりました。さらに、これらのエネルギー供給過程を調整することで、てんかん病態の発展を予防する可能性が示唆されました。これらの脳内エネルギーのダイナミクスを規定する要因は、生理的条件下でも働いている可能性があります。したがって、脳内エネルギー動態への介入が、情報処理の特性に影響を与える可能性があることが示されました。
研究概要: 血液中に含まれるエネルギー源をガソリンのようにとらえることができ、給油ホースの直径の調節を血管が担い、給油ノズルの調節をアストロサイトが担い、神経細胞がバイクのアクセルをふかすことでエネルギーを消費していると比喩的に捉えることができます。実際には脳内では、血管を通じて供給される血液中のグルコースと酸素が、エネルギー源として利用されます。アストロサイトはグルコースからピルビン酸を生成し、さらに乳酸に変換して神経細胞に受け渡します。神経細胞は、この乳酸を再びピルビン酸に変換し、ミトコンドリアを介してATPを産生します。マウスの海馬を電気刺激すると、過剰な神経発振が引き起こされました。この際、アストロサイト内のピルビン酸濃度が上昇し、神経細胞内のATP濃度が減少しました。これは、神経細胞へのエネルギー供給に変化が生じたことを示唆しています。このように、血管‐アストロサイト‐神経細胞間の代謝エネルギーの供給と消費のダイナミクスによって脳機能は制御されています。そのため、代謝を調節することで脳の病態を治療する新たな戦略が期待されます。
謝辞
本研究は、文部科学省研究費補助金JSPS KAKENHI(JP22K15218、JP24K18234、JP19H03338、JP22H02713)、学術変革領域(A)「グリアデコーディング」(JP20H05896)、学術変革領域(A)「行動変容生物学」(JP23H04659)、新学術領域研究「脳情報動態」(JP18H05110、JP20H05046)、新学術領域研究「レゾナンスバイオ」(JP15H05948)、Brain/MINDS(JP15dm0207001)、東北大学未来型医療創造卓越大学院プログラム、JST SPRING(JPMJSP2114)、理化学研究所基礎科学特別研究員、難治疾患共同研究拠点共同研究、光科学技術研究振興財団、武田科学振興財団、上原記念生命科学財団の支援を受けて行われました。本論文は「東北大学2024年度オープンアクセス推進のためのAPC支援事業」によりOpen Accessとなっています。
用語説明
- ATP:アデノシン三リン酸(ATP)は、生物の細胞内でエネルギー通貨として機能しています。ATPからリン酸がひとつ外れてアデノシン二リン酸(ADP)になる際に発生するエネルギーが、さまざまな細胞機能に利用されます。一方、細胞内で最も効果的にATPが生成される経路としては、好気的解糖(酸素を利用するエネルギー産生経路)が挙げられます。細胞外のグルコースを取り込んだ細胞は、解糖系によってこれをピルビン酸に変換し、ピルビン酸は細胞内のミトコンドリアに取り込まれ、クエン酸回路を経てNADHやFADH₂(還元型補酵素)が生成され、電子伝達系を介してATPが多量に生成されます。このように、細胞内のATP濃度は供給(生成)と消費のバランスによって維持されていますが、ATPは生体内のすべての細胞の機能と生存に必要不可欠なエネルギー分子であるため、生理的な状況下ではその濃度が一定に保たれていると考えられてきました。 ↩︎
- てんかん:てんかんとは、脳が一時的に過剰に興奮することにより、意識を失ったり、けいれんを引き起こしたりする発作を伴う病気です。てんかん発作では、脳の神経細胞で過剰な電気的興奮が生じ、脳波計で記録すると多数の神経細胞が周期的に活動する様子が確認できます。このような神経活動は「神経発振」と呼ばれることがあります。てんかんの原因はさまざまで、遺伝的要因、脳の損傷、発達異常、感染症、脳腫瘍、脳血管障害、外傷などが関与していると考えられています。てんかんには、発作を一度または数回経験する人から、頻繁に発作が起こる人まで、重症度に差があります。また、けいれん発作が繰り返されることで、てんかんが増悪化する場合も多いことが知られています。てんかんは人口の約1%が罹患する脳の疾患であり、世界中で研究が進められていますが、てんかん発作時の脳内の代謝エネルギー分子の動態についてはほとんど知られていませんでした。 ↩︎
- てんかんの突然死:てんかん患者の中には外傷や溺死が原因ではなく突然、予期せぬ死を迎えるケースがあります。このようなてんかんの突然死(sudden unexpected death in epilepsy; SUDEP)は、てんかん関連死の中で最も多く、年間1,000人に1~2人程度のてんかん患者が死亡しています。しかし、なぜてんかんの突然死が起こるのかは現時点では解明されていません。本研究では、動物実験における倫理的な配慮から、マウスにおけるてんかんの突然死をできるだけ避ける方策を取っていたにもかかわらず、3例のSUDEP事例に遭遇しました。細胞死に伴い細胞内ATPが大幅に減少することが予想されるため、これらのマウスで記録されたSUDEP事例は、細胞内ATPセンサーの機能性を補償する機会となるとともに、通常のてんかん発作時におけるATP濃度減少幅に関しても有益な指標を提供する貴重な機会となりました。 ↩︎
- アストロサイト:脳実質を構成する神経細胞以外の細胞はグリア細胞と呼ばれ、脳内には神経細胞に匹敵する数のグリア細胞が存在します。グリア細胞は、大きく分けて、アストロサイト、ミクログリア、オリゴデンドロサイトに分類されます。脳内での情報処理は、膨大な数の神経細胞が構成するネットワークによって実行されていると考えられています。一方、グリア細胞は、神経組織を構造的に支え、神経細胞に栄養因子を受け渡すためだけの細胞群として長らく考えられてきました。しかし近年、グリア細胞が神経回路の動作はさまざまな影響を与えることが報告されています。アストロサイトはグリア細胞の中で最も多く、脳内の血管と神経細胞間のシナプス両方に突起を伸ばしているため、特に神経情報処理と関連が深いと考えられています。アストロサイトは周囲の神経細胞の活動に反応し、伝達物質を放出したり、イオン濃度を調節したりすることで神経回路の動作に影響を与えます。さらに、アストロサイトは単に神経活動に受動的に反応するだけでなく、能動的に神経細胞の働きを制御する可能性が指摘されています。 ↩︎
- ピルビン酸:アストロサイトは血管からグルコースと酸素を受け取ります。受け取ったグルコースは解糖系によりピルビン酸に変換されます。したがって、血管からのグルコース供給量が増えると、ピルビン酸も増加すると考えられます。さらに、ピルビン酸は乳酸に変換され、モノカルボン酸トランスポーター(MCT)を介してアストロサイトから外へ排出されます。排出された乳酸は神経細胞のMCTを介して取り込まれ、最終的には神経細胞のエネルギー生産に利用されると考えられています(アストロサイト-神経間の乳酸シャトル仮説)。したがって、アストロサイトのMCT機能が低下すると、乳酸の排出が滞り、アストロサイト内に乳酸やピルビン酸が蓄積される可能性があります。 ↩︎
- 蛍光センサー:本研究においては、神経細胞内のATP濃度(ATeam)、アストロサイト内のピルビン酸濃度(PYRS)を反映するFRET型蛍光センサーを用いました。ATeamについては、ライプツィヒ大学のJohannes Hirrlingerらによる既報がありますが、PYRSは理化学研究所の新野祐介研究員、宮脇敦史チームリーダーらによって新規開発されたプローブです。また、血流量の変動は、血管内に蛍光色素Texas Redを流すことで計測しました。 ↩︎
- イオンバランス:生きている細胞では、Na+/K+-ATPase(NKA)機構が働き、細胞内のナトリウムイオンを細胞外に排出し、細胞外のカリウムイオンを細胞内に取り込みます。このため、細胞内ではカリウムイオン濃度が高く、細胞外ではナトリウムイオン濃度が高く保たれています。NKAは濃度勾配に逆らって働くため、ATPのエネルギーを必要とします。神経細胞では、細胞の膜電位がミリ秒単位で一過性に変動する活動電位によって、脳内情報を符号化しています。活動電位が発生するたびに、ナトリウムイオンが細胞内に流入し、カリウムイオンが細胞外に流出します。活動電位によって崩れた細胞内外のイオンバランスを元に戻すためにNKAが働き、脳で使われるATPの多くはNKAを作動させるために消費されると考えられてきました。 ↩︎
- グルコース:ATPエネルギー分子を効率的に生成するために、素材となるグルコースと酸素は血管を通じて脳内に供給されます。脳内血管と神経細胞は直接接していないため、グルコースはまずアストロサイトに取り込まれ、ピルビン酸に変換された後、さらに乳酸に変換されます。その後、乳酸はアストロサイトから神経細胞へと受け渡され、神経細胞内に再びピルビン酸に変換され、ミトコンドリアに取り込まれてATPが生成されると考えられています。このような経路を通じて、神経細胞は自身が有効に利用できるエネルギー源であるATPを得ています。 ↩︎
- 脳内情報処理:思考時にヒトの脳が消費するエネルギーは、約21ワットで、これは薄い白熱球を灯す程度のエネルギー量に相当する推定されています。一方、パソコンは約700ワット、スパコンでは125万ワットもの電力を使用しており、生物の脳は驚異的な省エネ性能を実現していると言えます。この秘密の一端は、脳内での代謝エネルギー分子の動態を調べることで明らかにされることが期待されています。 ↩︎
- ファイバーフォトメトリー法:脳内の神経細胞の電気的活動を捉えるためには、これまで脳波などの電気生理学的計測法が用いられてきました。一方、アストロサイトや神経細胞におけるCa2+や代謝産物の流れを蛍光センサー分子を用いて計測する方法も開発されています。その中でも、ファイバーフォトメトリー法は、高価な顕微鏡を必要とせず、自由行動下のマウスから長期記録を取得できる方法として、世界中で広く用いられている研究手法です。しかし、蛍光を発現していない血管が蛍光信号を遮ることや、多くの蛍光センサー分子がpHの影響を受けることについては、十分に理解されていません。本研究グループでは、新たな蛍光解析法を開発し、血流量と細胞内pHの要因を分離して推測する方法を確立してきました(Ikoma et al., Brain 2023)。 ↩︎
- ATeam:蛍光タンパク質のCFPとYFPをATP結合部位で連結したFRET型蛍光センサータンパク質です。センサーにATPが結合すると、CFPからYFPへのエネルギー伝達効率が向上し、CFPの蛍光が弱まり、YFPの蛍光が強くなります。本研究グループでは、YFPを直接励起するdYFP蛍光を同時取得する手法をATeamに初めて適用することで、血流とpHの影響を分離し、ATP濃度の変動を正確に計測しました。 注12.PYRS:CFPとYFPをピルビン酸結合部位で連結したFRET型蛍光センサーです。ATeamとは異なり、ピルビン酸が結合するとFRET効率が低下する特性を持ちます。本研究で新たに発表されたセンサータンパク質です。 ↩︎
- PYRS:CFPとYFPをピルビン酸結合部位で連結したFRET型蛍光センサーです。ATeamとは異なり、ピルビン酸が結合するとFRET効率が低下する特性を持ちます。本研究で新たに発表されたセンサータンパク質です。 ↩︎
論文情報
タイトル:Dynamics of neuronal and astrocytic energy molecules in epilepsy
著者:Kota Furukawa, Yoko Ikoma, Yusuke Niino, Yuichi Hiraoka, Kohichi Tanaka, Atsushi Miyawaki, Johannes Hirrlinger, Ko Matsui*
筆頭著者:東北大学大学院生命科学研究科 超回路脳機能分野 博士課程大学院生 古川 孝太
*責任著者:東北大学大学院生命科学研究科 超回路脳機能分野 教授 松井 広
研究者:https://researchmap.jp/komatsui/
研究室:http://www.ims.med.tohoku.ac.jp/matsui/
掲載誌:Journal of Neurochemistry
DOI:https://doi.org/10.1111/jnc.70044
URL:https://onlinelibrary.wiley.com/doi/10.1111/jnc.70044
問い合わせ先
(研究に関すること)
東北大学大学院生命科学研究科
教授 松井 広(まつい こう)
TEL:022-217-6209
Email:matsui*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院生命科学研究科広報室
高橋 さやか(たかはし さやか)
TEL:022-217-6193
Email:lifsci-pr*grp.tohoku.ac.jp(*を@に置き換えてください)
- 関連資料
- プレスリリース資料(PDF)
- 関連リンク
- 超回路脳機能分野


