ALSの異なる原因が共通の遺伝子「UNC13A」の発現異常に収束 病気の全貌解明へ新知見
2025.7.25 Fri
研究発表のポイント
- 筋萎縮性側索硬化症(ALS)1に関わる複数のたんぱく質(TDP-43、FUS、MATR3、hnRNPA1)が、神経の働きに重要な遺伝子「UNC13A」の発現を維持する役割を担っていることを明らかにしました。
- ALS関連たんぱく質が失われると、UNC13Aたんぱく質のもとになるmRNA2が分解されやすくなる経路があることは知られていましたが、今回、「REST」3という発現抑制たんぱく質が過剰となりUNC13AのmRNA産生が抑えられる別の経路があることを新たに発見しました。
- ALSの発症に関わる遺伝子やたんぱく質は多数あり、治療標的を絞ることが困難と考えられてきました。しかし本研究により異なる病因がUNC13Aという遺伝子の発現異常に収束することがわかり、治療法開発の有力な手がかりとなります。
概要
運動神経細胞が徐々に少なくなっていくことで力が入らなくなる難病ALSは、原因が多様で発症や進行のメカニズムの解明が難しいとされてきました。
東北大学大学院医学系研究科の渡辺靖章助教らと、慶應義塾大学再生医療リサーチセンターの森本悟副センター長らの共同研究グループは、ALSの発症に関わる4種類のRNA結合たんぱく質4をそれぞれ欠損させた神経系培養細胞を用いて、遺伝子発現を解析しました。その結果、mRNAの不安定化による分解の活発化あるいは発現抑制たんぱく質RESTの増加によるmRNAの産生抑制を通じて、神経の働きに重要なUNC13Aという遺伝子の発現が顕著に減少していることを発見しました。さらに、ALS患者の遺伝子変異を持つiPS細胞5由来の運動神経細胞やALS患者剖検組織において、UNC13Aの発現を抑制する働きのあるRESTが過剰に存在することが確認されました。今回の成果は、ALSの発症に関わる4種類のRNA結合たんぱく質の機能が失われることにより、神経細胞の働きを支えるUNC13A遺伝子の発現が抑制される可能性を示したもので、病気の本質的な理解につながる重要な一歩です。
本研究成果は2025年7月24日 (日本時間19 時) に国際科学誌The EMBO Journal (電子版) に掲載されました。
詳細な説明
研究の背景
ALS(筋萎縮性側索硬化症)は、運動神経細胞が失われてしまうことで手足や全身の筋力が徐々に低下する難病で、原因はまだ完全には解明されていません。ALSの主要な原因遺伝子としてRNA結合たんぱく質の遺伝子が数多く含まれ、それら遺伝子の変異がそれぞれ異なる経路で細胞に障害を起こすため、共通の仕組みを見いだすことが困難とされてきました。こうした中、近年の研究では「UNC13A」という遺伝子の発現異常がALSと深く関係している可能性が注目されています。UNC13Aは神経細胞が適切に情報を伝えるために不可欠で、うまく働かなくなると神経の機能が損なわれると考えられています。
今回の取り組み
東北大学大学院医学系研究科創生応用医学研究センター細胞増殖制御分野の渡辺靖章(わたなべ やすあき)助教、中山啓子(なかやま けいこ)教授の研究チームと、同大学大学院医学系研究科臨床障害学分野の鈴木直輝(すずき なおき)准教授、神経内科学分野の青木正志(あおき まさし)教授、慶應義塾大学再生医療リサーチセンターの森本悟(もりもと さとる)副センター長、岡野栄之(おかの ひでゆき)センター長らは共同で、ALSに関わる複数のたんぱく質の機能異常が、神経細胞の働きを支えるUNC13AのRNAとたんぱく質の量を減らすことを明らかにしました。異なる原因で発症するALSでも、最終的にこのたんぱく質が不足するという共通の病態に収束することを示した点で、ALSの発症機序の統合的理解と治療開発の糸口につながる重要な研究成果です。
研究チームは、ALSで異常が起きていることで知られる4種類のRNA結合たんぱく質であるTDP-43、FUS、MATR3、hnRNPA1について遺伝子編集技術を用いて一つずつ欠損させた4種類の神経系培養細胞を作製し、UNC13A たんぱく質のもとになるmRNAの変化を調べました。すると、これらすべての細胞でUNC13AのmRNAが著明に減少していることが確認されました(図1A)。
UNC13AのmRNAは、mRNAに不要な部分(隠れエキソン6)が入り込むと不安定になって分解されやすくなることが知られているので、UNC13AのmRNAが減っていた4種類のたんぱく質欠損細胞で、UNC13AのmRNA内の隠れエキソンの存在量を調べました。すると、TDP−43欠損細胞では隠れエキソンが検出されましたが、それ以外の3種類の細胞では検出されませんでした(図1B)。つまり、TDP-43欠損細胞とそれ以外の細胞では、UNC13A のmRNAが減少する仕組みが異なることが示唆されました。
そこで、UNC13A のmRNAの産生を抑える発現抑制たんぱく質であるRESTの量を調べたところ、3種類の欠損細胞ではRESTが野生型よりも増加していましたが、TDP-43欠損細胞では変化はありませんでした(図1C)。このことから、MATR3, FUS, hnRNPA1の異常では、RESTの増加が起きることでUNC13AのmRNAが作られなくなることがわかりました。
さらに、ALS患者由来のiPS細胞から作製した運動神経細胞や、東北大学病院に過去に入院していたALS患者の剖検脊髄組織を調べたところ、RESTが増加していることが実際に確認され(図1 D, E)、RESTの増加はALS患者の運動神経でも関与していることが裏付けられました。
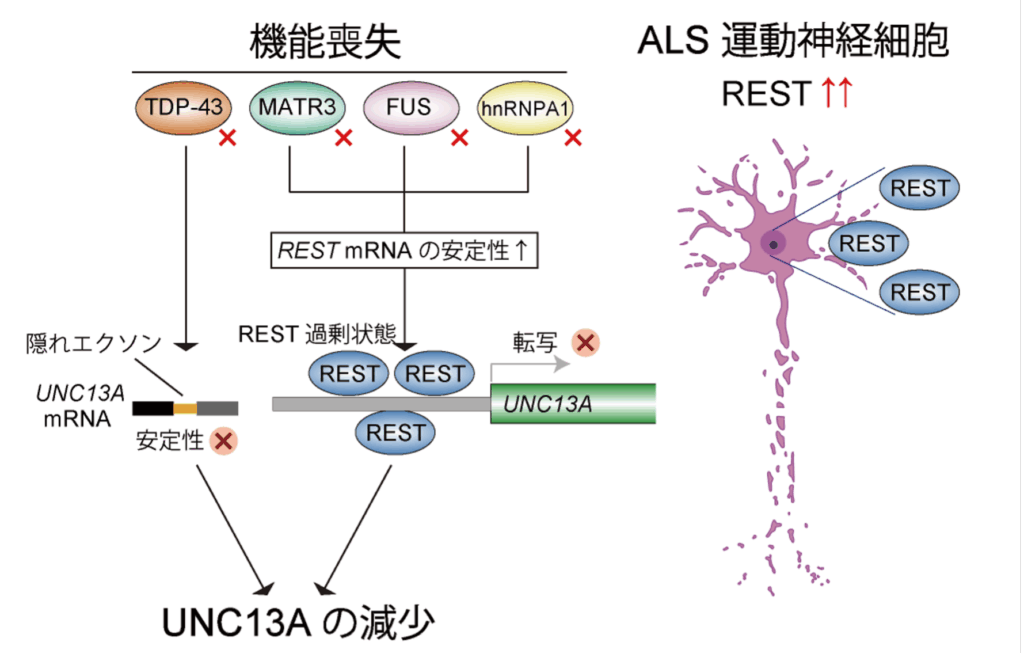
これらの結果から、TDP-43の欠損に伴ってUNC13AのmRNAが分解されやすくなりUNC13AのmRNAが減少するというこれまで知られていた経路に加えて、FUS・MATR3・hnRNPA1の機能が失われるとRESTが過剰に増加することでUNC13AのmRNA産生そのものが抑えられてしまうという新しい経路が存在することがわかりました(図2)。このように、RNA結合たんぱく質に関わるALSの病態は、異なるたんぱく質の異常が2つの経路をたどりながらも、共通してUNC13Aの不足に行き着くことがわかりました。
今後の展開
UNC13Aの不足が、ALSにおける主要な病態関連遺伝子やたんぱく質異常の共通下流であることが示され、発症メカニズムの理解に向けて新しい視点が得られました。原因が多様で複雑なALSを、「神経細胞の働きを支えるUNC13Aという共通の遺伝子の発現異常」として再整理することで、治療標的を見出す手がかりが得られました。今後はRESTがALS病態にどのように関わっているかをより詳しく調べることにより、神経細胞を保護する仕組みの解明や、治療法開発に向けた研究が期待されます。
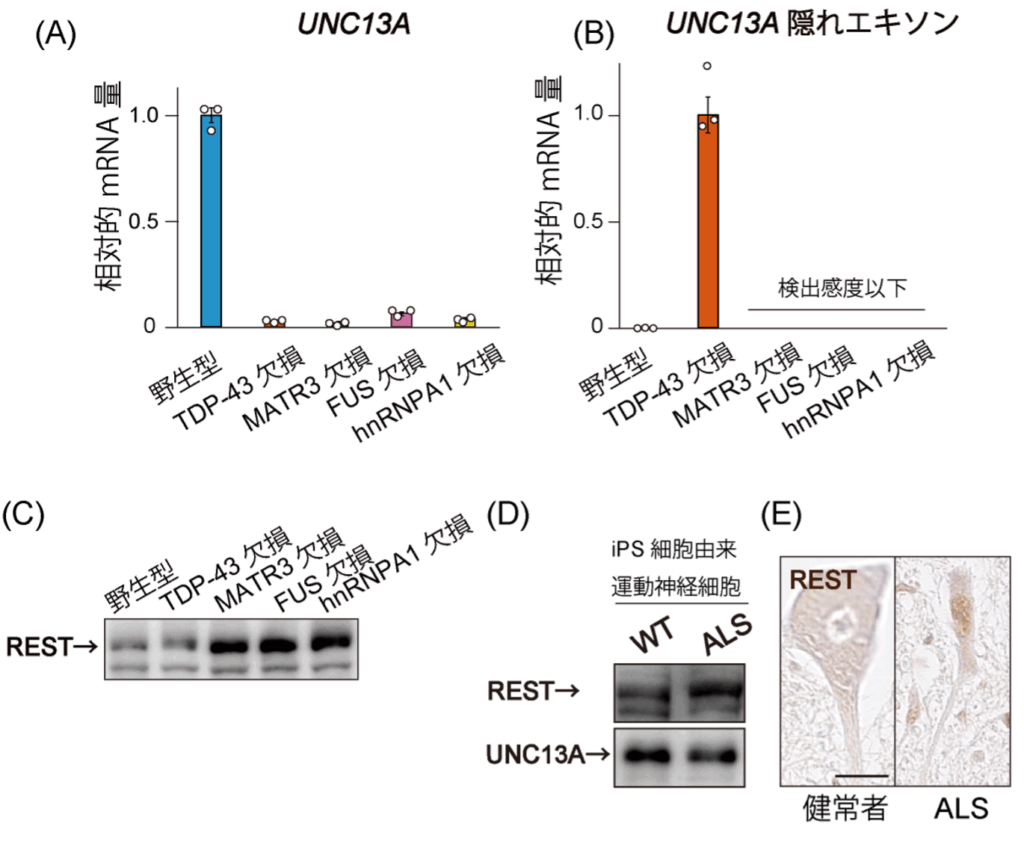
図1.ALS関連遺伝子欠損によるRESTを介したUNC13A発現抑制
(A) ALSの原因に関わる4つのたんぱく質(TDP-43, MATR3, FUS, hnRNPA1)をそれぞれ欠損させた細胞におけるUNC13Aの mRNA検出実験。いずれの欠損細胞でも、野生型細胞に比べてUNC13AのmRNA量が著減している。
(B) UNC13AのmRNAに含まれる隠れエキソンの検出実験。TDP-43の欠損細胞ではUNC13A mRNAの中に隠れエキソンが挿入されてしまうことでUNC13A mRNAが不安定化するが、それ以外の細胞では、隠れエキソンが挿入されていない。
(C) 4種類のたんぱく質欠損細胞におけるRESTたんぱく質の存在量を調べた免疫ブロット。TDP-43欠損細胞以外のMATR3, FUS, hnRNPA1の欠損細胞ではRESTが増加している。
(D) FUS遺伝子変異を持つALS患者iPS細胞由来運動神経細胞を用いた免疫ブロット。RESTの増加とUNC13Aの減少がみられる。
(E) 健常者および家族性ALS患者の剖検脊髄におけるRESTの免疫染色。家族性ALSの運動神経細胞の核では茶褐色に染まるRESTが検出される。
謝辞
本研究は、以下の助成を受けて実施されました([ ]内は代表者名)。JSPS科研費JP22K15702[渡辺靖章], JP21K07411[鈴木直輝], JP23H02821[青木正志], JP21H02458, JP24K02300[中山啓子], JP21H05278, JP22K15736[森本悟]、日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療実現加速化プログラム「筋萎縮性側索硬化症における病態回避機構の解明と治療に資する層別化技術開発」、精神・神経疾患メカニズム解明プロジェクト「孤発性筋萎縮性側索硬化症の双方向トランスレーショナル研究による病態介入標的の同定と核酸医薬の開発研究」[岡野栄之]、再生・細胞医療・遺伝子治療実現加速化プログラム「革新的RNA編集技術を用いた筋萎縮性側索硬化症の遺伝子治療開発」、ゲノム創薬基盤推進研究事業「RNA標的医薬創出に資する、疾患RNA分子完全長一次構造に関するデータ基盤の構築」[森本悟]、難治性疾患実用化研究事業 「遺伝子治療時代のALS治験即応型レジストリ整備とサロゲートマーカーの探索」[青木正志]の支援を受けました。また、日本ALS協会、宮田幸比古記念ALS研究助成金[渡辺靖章]、第一三共生命科学研究振興財団、加藤記念難病研究振興財団、稲盛財団[森本悟]による助成も受けています。本論文は『東北大学2025年度オープンアクセス推進のためのAPC支援事業』の支援を受け、Open Accessとなっています。
用語説明
- ALS(筋萎縮性側索硬化症):運動神経細胞が徐々に変性・脱落する難治性の神経変性疾患で、筋力の低下や呼吸障害を引き起こす。 ↩︎
- mRNA:DNAの遺伝情報をもとに細胞内でたんぱく質を作る際にもとになる分子。 ↩︎
- REST:神経の分化や活動を抑制する転写因子で、ストレス応答や神経疾患との関連が近年注目されている。別名NRSF。 ↩︎
- RNA結合たんぱく質:RNAに結合してその働きや安定性、翻訳、スプライシングなどを調節するたんぱく質群で、神経疾患との関係が注目されている。 ↩︎
- iPS細胞:人工多能性幹細胞。皮膚や血液などの体細胞から作られる、さまざまな細胞に分化できる細胞。患者由来の神経細胞を作成して病態を解析する研究に用いられている。 ↩︎
- 隠れエキソン:クリプティックエキソン(cryptic exon)として知られる。本来は取り除かれるはずのRNA配列が異常に取り込まれてしまったエキソン様配列で、異常なたんぱく質の産生やRNAの分解を引き起こす。 ↩︎
論文情報
タイトル:ALS-associated RNA-binding proteins promote UNC13A transcription through REST downregulation
著者:Yasuaki Watanabe*, Naoki Suzuki, Tadashi Nakagawa, Masaki Hosogane, Tetsuya Akiyama, Naotoshi Kageyama, Yukino Funayama, Hitoshi Warita, Satoru Morimoto, Hideyuki Okano, Masashi Aoki, and Keiko Nakayama*
*責任著者:東北大学大学院医学系研究科 細胞増殖制御分野 助教 渡辺靖章、同 教授(兼)東京科学大学 リサーチインフラマネジメント機構 副学長 中山啓子
掲載誌:The EMBO Journal
DOI:10.1038/s44318-025-00506-0
問い合わせ先
(研究に関すること)
東北大学大学院医学系研究科 細胞増殖制御分野
助教 渡辺靖章
TEL:022-717-8227
Email:yasuaki.watanabe.b8*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院医学系研究科・医学部広報室
東北大学病院広報室
TEL:022-717-8032
Email:press.med*grp.tohoku.ac.jp(*を@に置き換えてください)
- 関連資料
- プレスリリース資料
- 関連リンク
- 細胞増殖制御分野分野 臨床障害学分野 神経内科学分野 リハビリテーション科 脳神経内科


