発表のポイント
- 小児の腸管不全に伴う重篤な肝障害(腸管不全関連肝障害:IFALD1)における栄養(必須脂肪酸)補給を目的とした未承認薬「魚油由来静注用脂肪乳剤(Omegaven®)2(以下、本剤)」の安全性と有効性を検証する医師主導治験において、目標症例数20例の登録および治験薬投与を終了しました。
- 本剤は、2025年5月の「医療上の必要性の高い未承認薬・適応外薬検討会議」において、開発の必要性が特に高い医薬品として評価されました。
- 本治験の終了により、国内承認および保険適用に向けた動きが加速し、小児腸管不全患者の生命予後およびQOL(生活の質)の改善が期待されます。
概要
小児の腸管不全では静脈栄養が必要ですが、従来の大豆油由来脂肪乳剤3はIFALDの原因となります。また、本剤はIFALD の予防・改善に有効とされ海外35カ国以上で承認されていますが、国内では未承認のため、患者は従来の治療を続けざるを得ませんでした(図1)。
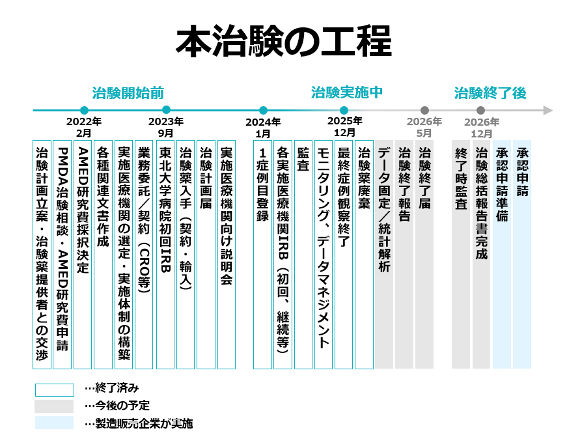
東北大学大学院医学系研究科小児外科学分野の和田 基教授と東北大学病院総合外科・小児外科グループは、小児のIFALDに対するOmegaven®の医師主導治験(第III相試験)を実施しました。2025年12月11日に目標とする20例の症例登録および治験薬投与を完了し、治験を終了しました(図2)。また、本剤は、2025年5月9日開催の厚生労働省「医療上の必要性の高い未承認薬・適応外薬検討会議」において、医療上の必要性が高いと評価されています。
本治験の成果は、国内での薬事承認申請のための重要なデータとなり、日本の小児医療におけるアンメット・メディカル・ニーズ(未だ満たされていない医療ニーズ)の解消に寄与するものです。
詳細な説明
研究の背景と経緯
小児、特に新生児や乳児において、腸管の切除(短腸症候群)や機能不全により腸から十分な栄養が摂れない「腸管不全」の場合、生命維持と成長のために静脈栄養が不可欠です。しかし、従来の「大豆油由来」の脂肪乳剤を使用した静脈栄養を長期間継続すると、その成分の影響等により、重篤な肝障害であるIFALDを引き起こすことが知られています。IFALDが進行すると肝硬変に至り、致死的な経過をたどることも少なくありません。
これに対し、「魚油由来」の脂肪乳剤であるOmegaven®は、抗炎症作用を持つオメガ3系脂肪酸(DHA、EPAなど)を豊富に含み、IFALDの予防や改善に有効であることが海外の研究で示されています。しかし、本邦では未承認であるため、多くの患児がリスクを抱えながら従来の治療を続けざるを得ない状況にありました。
研究の内容
東北大学大学院医学系研究科小児外科学分野の和田 基(わだ もとし)教授と東北大学病院総合外科・小児外科グループは、IFALDを発症した、または発症リスクの高い小児腸管不全患者を対象に、Omegaven®を投与した際の有効性と安全性を検証する第III相医師主導治験を実施しました(研究期間4年)。
3年目となる2025年に、目標症例数である20例の登録を達成し、全例の投与期間が終了しました。現在、データの固定および解析の最終段階に入っています。
本治験は、15歳未満の小児のIFALD(血液検査において、直接ビリルビン値が1.0 mg/dl以上の胆汁うっ滞(黄疸)やAST, ALTなどの肝機能の検査値が正常の3倍以上の値が2週間以上続く肝機能障害)の患者20名を対象とし、治験薬の投与によって栄養、特に必須脂肪酸が十分に補給されることを試す治験です。
治験薬のOmegaven®はオメガ3系脂肪酸を豊富に含み、オメガ6系脂肪酸であるアラキドン酸も適量含んでいるため、単独投与でも必須脂肪酸欠乏を来たさないと考えられています。本治験は、Omegaven®を用いることで、IFALDを抱える患児に対しても、肝臓への負担を回避しつつ安全に栄養(必須脂肪酸)補給が可能であることを証明するものです。
本治験では、必須脂肪酸欠乏の指標としてTT比(エイコサペンタエン酸/アラキドン酸の比率)を用い、小児IFALDの患者に治験薬を体重1kgあたり1g (10 ml)を毎日56日間投与し、57日目のTT比が0.05未満(小児の正常値)であることを確かめます(主要評価項目)。さらに被験者は肝機能障害が軽快あるいは静脈栄養が不要となるまで、最大112日間(合計168日間)治験薬の投与を継続し、TT比の変化のほか、体重や身長などの成長・発育への影響、肝機能数値の改善効果(直接ビリルビン値の推移等)や、副作用の有無などを副次評価項目として詳細に評価しています。治験の結果は治験薬の日本国内での承認のために使用します。
また、2025年5月9日、厚生労働省の「医療上の必要性の高い未承認薬・適応外薬検討会議」において、Omegaven®は「医療上の必要性に係わる基準」への該当性があるとの評価結果が了承され、開発要請がなされる見込みとなりました。
今後の展開
本治験の終了と良好な結果(見込み)は、この社会的要請に応えるものです。今後は得られた治験データを基に、協力企業を通じて速やかに薬事承認申請を行う予定です。本剤が承認されれば、国内の小児腸管不全患者にとって待望の治療選択肢となり、肝移植を回避し生存率を向上させる画期的な治療法となることが期待されます。
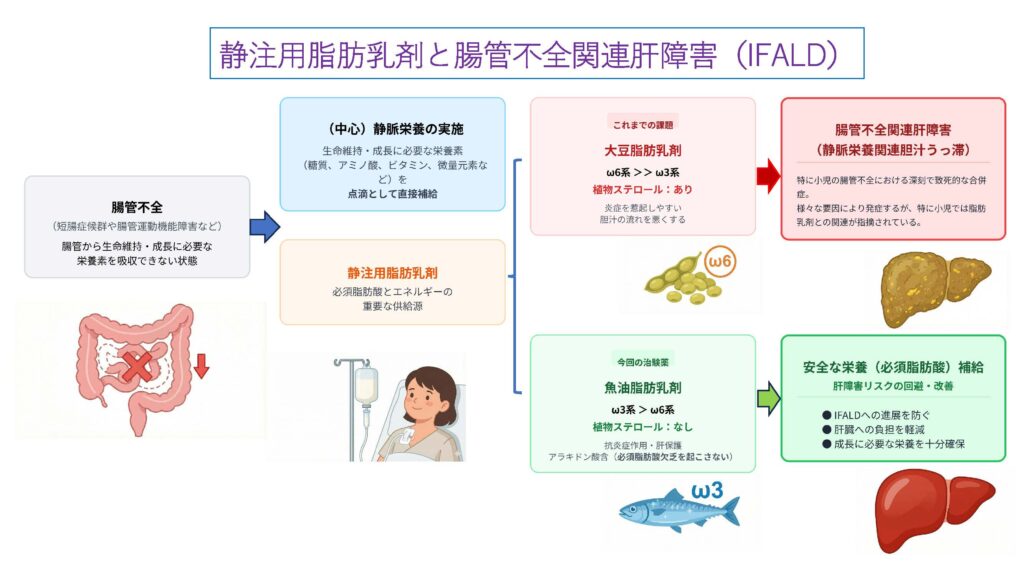
短腸症候群などの「腸管不全」の小児患者は、腸から栄養を吸収できないため、「静脈栄養(点滴)」によって糖質・アミノ酸・ビタミン等を補給し、生命を維持しています。中でも「静注用脂肪乳剤」は、効率的なエネルギー源であると同時に、体内で合成できない必須脂肪酸を補給するために不可欠な薬剤です。
従来使用されてきた「大豆脂肪乳剤」は、炎症を引き起こす物質の原料となるオメガ6系脂肪酸が多く、また植物ステロールを含んでいます。これらは、小児の静脈栄養における致死的な合併症「腸管不全関連肝障害(IFALD/静脈栄養関連胆汁うっ滞)」の主要な原因であると指摘されています。
対して、本治験で使用した「魚油脂肪乳剤(Omegaven®)」は、炎症を抑制するオメガ3系脂肪酸を豊富に含み、肝障害の原因となる植物ステロールを含みません。さらに、オメガ6系脂肪酸であるアラキドン酸も適量含んでいるため、単独投与でも必須脂肪酸欠乏を来たさないと考えられています。
本治験は、魚油脂肪乳剤を用いることで、重篤な肝障害(IFALD)を抱える患児に対しても、肝臓への負担を回避しつつ安全に栄養(必須脂肪酸)補給が可能であることを証明するものです。
謝辞
国立研究開発法人日本医療研究開発機構(AMED)「小児静脈栄養関連胆汁うっ滞(腸管不全関連肝障害)に対する魚油由来静注用脂肪乳剤の有用性と安全性に関する医師主導治験」(臨床研究・治験推進研究事業)と、東北大学病院臨床研究推進センター(CRIETO)の支援のもと実施されました。
全国の治験実施施設、責任医師、関係者のみなさま、ご支援いただいた関連学会、研究会のみなさまに感謝します。
用語説明
- 腸管不全関連肝障害(IFALD):静脈栄養を長期に行うことで発症する胆汁うっ滞や肝機能障害。進行すると肝不全に至る重篤な合併症。 ↩︎
- 魚油由来静注用脂肪乳剤(Omegaven®):純魚油を原材料としてミセル化(乳化)し、静脈投与を可能とした注射薬。EPAやDHAなどのオメガ3系脂肪酸を豊富に含む。オメガ6系脂肪酸の含有量は少ないが、アラキドン酸などは適量含むため、単独投与でも必須脂肪酸欠乏をおこしにくいと報告されている。欧州などでは古くから主に大豆脂肪乳剤などと併用し、オメガ3系脂肪酸を補うことを目的に承認されていたが、小児の適応は有さず、腸管不全関連肝障害に対する適応もなかった。2000年代後半よりボストン小児病院などで小児の静脈栄養関連胆汁うっ滞(腸管不全関連肝障害のうち胆汁うっ滞を伴う病態)に対し使用されるようになり、2018年に米国FDAにおいて、小児静脈栄養関連胆汁うっ滞における栄養補給を適応として承認された。 ↩︎
- 大豆油由来脂肪乳剤:大豆油を原材料とする静注用脂肪乳剤。日本国内で静注用脂肪乳剤として承認されているのは、現状この脂肪乳剤のみである。オメガ6系脂肪酸を豊富に含むが、オメガ3系脂肪酸はほとんど含まず、胆汁うっ滞などの肝機能障害の原因となる植物ステロールを含むことなどから、腸管不全関連肝障害の主な原因とされている。 ↩︎
問い合わせ先
(研究に関すること)
東北大学大学院医学系研究科 小児外科学分野
教授 和田 基(わだ もとし)
TEL:022-717-7235
Email:motoshi.wada.d5*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学大学院医学系研究科・医学部広報室
東北大学病院広報室
TEL:022-717-8032
Email:press.med*grp.tohoku.ac.jp(*を@に置き換えてください)
- 関連資料
- プレスリリース資料(PDF)
- 関連リンク
- 小児外科学分野 総合外科 小児外科グループ


